「網膜色素変性症」は網膜にある視細胞の機能が低下する遺伝性の疾患だ。視細胞は光を神経信号に変換して視神経に情報を伝える働きをしているが、この細胞が破壊されると「夜盲」や「視野狭窄」の症状が現れ、さらに進行すると明るいところでも見えにくくなり、視力を失うこともある。有効な治療法のない難病だが、網膜を再生させようという再生医療の研究により、一筋の光明が見えてきた——。
特集 ここまできた再生医療難病の網膜色素変性症に「網膜再生」で一筋の光明
構成/渡辺由子
私たちの眼をカメラに例えると、フィルムの役割を果たしているのが、眼球の後ろ側を覆う薄い膜状の網膜です。網膜には光を感じる視細胞や、視細胞に栄養を与え、老廃物を処理するなどメンテナンスの役割を担う網膜色素上皮細胞(以下、RPE細胞)など、神経細胞が層状に重なっています(図1)。
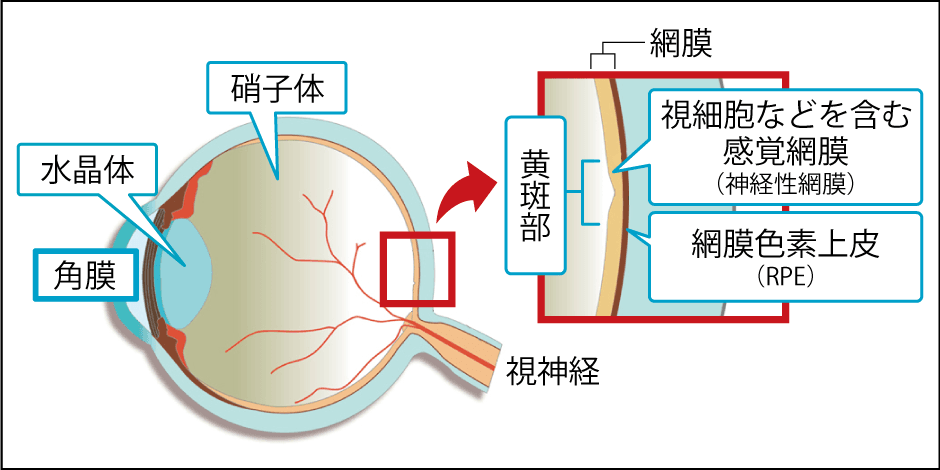
図1 眼の構造カメラのフィルムの役割を果たす網膜は、光を感じ取る視細胞や、視細胞を保護するRPE細胞などが層状になっている。網膜色素変性症は、視細胞やRPE細胞で働く遺伝子の異常で起こるとされ、進行性の難病である。
視細胞には、光を神経信号(電気信号)に変換し、眼から脳につながる視神経に情報を伝える働きがあり、脳で画像の情報に変換されることで、文字を読んだり、色を識別することができます。光を神経信号に変換するのは、網膜の視細胞にしかない働きで、そこでしか働かない多数の遺伝子があります。その中の一つでも正常に働かないと、異常なタンパク質が蓄積されるなどして本来の働きができなくなり、視細胞が壊れて失われることを「視細胞の変性」と呼んでいます。
視細胞は、「杆体細胞(以下、杆体)」と「錐体細胞(以下、錐体)」の2種類に大きく分けることができます。錐体は網膜の中心の黄斑部分に多く分布し、明るいところで光を感じ、中心の視力や色覚(色の識別)に関係する働きをしています。杆体は、網膜の中心以外に広く分布し、暗いところの弱いわずかな光でも感じられることや、視野の広さの役割を担っています。
網膜色素変性症は遺伝性の疾患
網膜色素変性症は、主に杆体で光を感じられなくなる変化から始まるため、暗いところで見えにくい「夜盲」や、視野が狭くなる「視野狭窄」の2つの症状が特徴として現れます。進行するにつれて錐体の働きも低下し、明るいところでも見えにくい症状が現れるようになります(図2)。
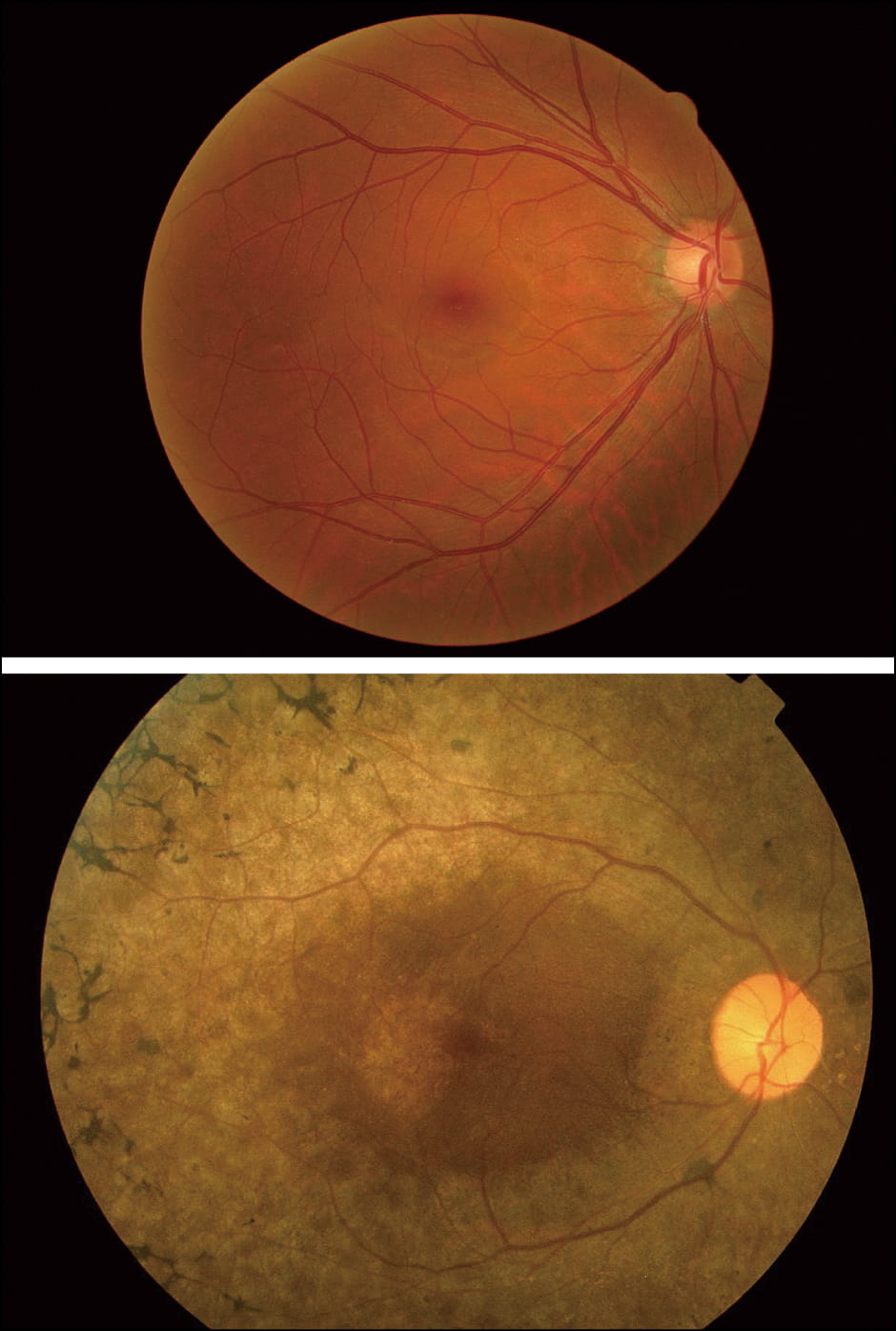
図2 正常な眼底と網膜色素変性症の眼底上段は正常な眼底写真、下段は網膜色素変性症の眼底写真。正常な眼底はオレンジ色から赤色の透明度が高く鮮明だが、網膜色素変性症の中期以降では、眼底周辺部に特徴的な色素沈着が現れる。
網膜色素変性症は遺伝性の疾患であり、原因となる遺伝子は現在50種類ほどが見つかっていますが、未解明の遺伝子がまだまだあると考えられます。また、患者の中で、原因の遺伝子が特定できるのが半数程度です。原因の遺伝子によって視細胞が減るスピードが異なると考えられ、発症の時期や症状、進行の度合いなどが患者ごとにバリエーションがあるために、個人差がとても大きいのもこの疾患の特徴です。例えば、小学生の頃から視力が出ずに、10代後半から20代前半くらいで光を感じにくくなることがあります。一方で、この疾患は基本的にゆっくり進行することや、錐体や杆体のどちらから機能が低下するかによって、症状に気づきにくいこともあるのです。錐体が悪くならず、中心部の視力が高齢でも1.0で保たれているなど、実にさまざまです。ただ、遺伝性の疾患なので、家系の中で同じ病気を発症している兄弟姉妹や親子では、似たような経過をたどることが多いようです。
検査は、視力検査、視野検査に加えて、眼底検査でこの疾患特有の眼底に沈着する色素を確認することができます。さらに、発症初期段階の診断に使われる網膜電図は、網膜に光が当たると神経信号が生じ、視神経から脳へ伝わる働きを利用する検査で、電極を付けたコンタクトレンズ状の機器を角膜にのせ、反応を調べます。最近では、光干渉断層計(OCT)で網膜の断層撮影を行うようになりました。網膜色素変性症では早期から網膜が普通より薄くなり、視細胞の変性を確認できるためです。
一筋の光が見えてきた再生医療
さて、本項のテーマである再生医療ですが、ES細胞(胚性幹細胞)やiPS細胞(人工多能性幹細胞)による再生医療が始まり、早期の実用化に期待が高まっているのが網膜の再生です。故・笹井芳樹医師(理化学研究所発生・再生科学総合研究センターのグループディレクター、同副センター長)が、1990年代後半に網膜の細胞がES細胞から作製できることを初めて明らかにし、2002年に報告しています。その後、理化学研究所生命機能科学研究センターの網膜再生医療研究開発プロジェクト プロジェクトリーダーだった髙橋政代医師(現・ビジョンケア代表取締役社長)らの研究グループは、ES細胞やiPS細胞から作製した網膜の細胞を移植する動物実験で検証を進めてきました。そして当院において、iPS細胞でヒトの網膜色素変性症や黄斑変性の治療法の開発をスタートさせたのです。
網膜色素変性症の再生医療は、視細胞が壊れて失われることから、視細胞を「補充」するという考え方で開発を進めています。網膜色素変性症の一部に、視細胞に栄養を供給し、メンテナンスも担っているRPE細胞の遺伝子の異常が原因で、二次的に視細胞が壊れていく場合があり、RPE細胞の移植により、視細胞が壊れていくのを抑えられるのではないか、という考え方もあります。原因を詳しく調べたうえで、いずれかの細胞が移植の対象になります。
網膜の再生医療で最初に実施されたのは、加齢黄斑変性の臨床研究です。近年、改善効果のある注射薬が承認されており、この再生医療で対象になるのは、注射による治療の効果がなくなった患者です。2013年に承認され、2014年に実施した臨床研究では、患者の細胞から作ったiPS細胞で、RPE細胞を作製し、シート状にして移植する、当時60代の女性に世界初の手術が行われました。安全性確認など基礎研究を重ね、10年越しで実現できた再生医療です(図3)。
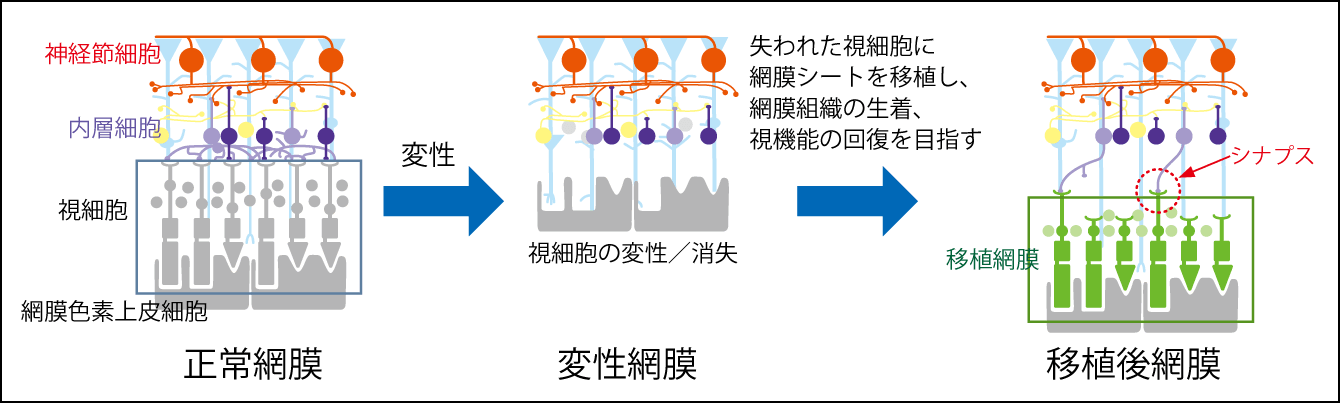
図3 網膜色素変性症に対する同種(ヒト)iPS細胞由来網膜シート移植の概要図神戸アイセンター病院では、他人由来の iPS 細胞から作製した網膜シートを網膜色素変性症患者の網膜下に移植する臨床研究を、 2020 年10月に実施。視細胞を含む網膜シートの生着や、がん化しないかを確認する世界初の臨床研究だ。視細胞が回復して、神経回路がつながることも期待される。
手術から6年半を経ましたが、シートは残っていて、患者は「見え方が明るくなった」と話しており、視力は維持されています。この患者は移植する際に黄斑部に形成された新生血管を取り除いた上に、シートを被せており、移植まで毎月注射による治療を行っていましたが、今に至るまで1回も注射せずにいます。今後も、患者自身の細胞を使用しているので、問題なく経過すると考えています。
次に行ったのは、加齢黄斑変性の患者への他人のiPS細胞由来の細胞移植です。このときはiPS細胞由来のRPE細胞をシートにせずに、凍結保存した細胞を解凍して増殖させ、元気にさせてから移植する方法を採用しています。2017年に5例に実施し、現在、移植細胞はある程度残っていて、注射による治療の必要がない患者もいますが、なかには病気の進行を抑えるまでにはいかず、追加の注射による治療を続けている患者もいます。この臨床研究では、全例、新生血管除去の手術をしていません。移植した細胞の力だけで進行を抑えるまでに至っていないことは、今後の克服すべき課題です。
難関の視細胞移植にチャレンジ
RPE細胞は、視細胞に栄養を供給したり、老廃物を除去したりするメンテナンスの細胞なので、移植をしても物質のやりとりができればよいのですが、ものを見る機能を司る視細胞の場合、移植された視細胞から神経が伸びていき、患者側に残っている神経に接続することが求められます。これまで、神経細胞が集まる中枢神経の再生は不可能とされてきたので、これがRPE細胞の移植とは異なって、高度で難しい点です。しかし、眼の機能を再生させるには、乗り越えなければならない過程です。
2020年10月に実施した臨床研究では、他人由来のiPS細胞から作製した、視細胞を含む網膜になる組織である神経網膜シートを移植しました。直径約1㎜、厚さ0.2㎜のシートを網膜下に3枚移植し、生着することや、がん化しないかを確認することを目的にしています。
動物実験では、移植された視細胞の神経と宿主側の神経がつながっていることを、組織の標本で確認できました(図4)。今回の臨床研究では、移植した細胞が視細胞として成熟し、「移植している細胞で光を感じている」という証拠を検査等で示すことができれば、間接的に「移植した網膜が働いている」と考えることができます。動物実験では、およそ半年後に神経のつながりを確認できたので、ヒトでも半年から1年経過すれば、確認できると考えています。
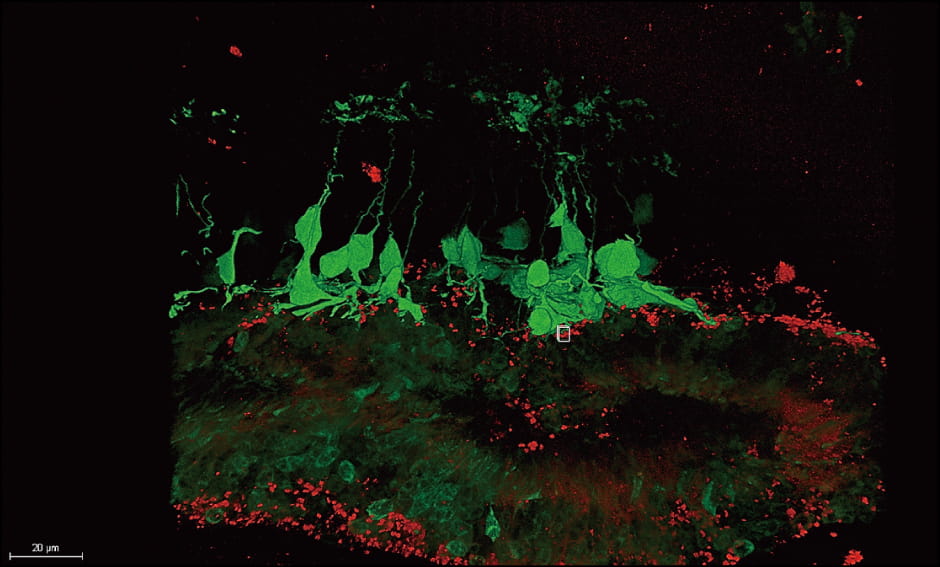
図4 マウスiPS細胞から分化させた網膜組織を移植した網膜変性末期マウスの網膜網膜組織を移植した後の網膜の蛍光顕微鏡画像。網膜変性末期マウスの双極細胞(視細胞の電気信号を神経節細胞に伝える細胞・緑)の軸索末端と、移植した視細胞のシナプス末端(赤)が接触していることが分かる。
(出典:Stem Cell Reports, 2017、提供:理化学研究所)
この臨床研究で少しでもプラスの結果が得られた、という前提でのことですが、小さい神経網膜シートでつながることを確認できれば、今後は大きいシートを移植することも考えられます。ただし、ヒトの網膜は、さまざまな細胞の配列が厳密であるからこそ、細かい文字などを判読できたり、微妙な色の識別ができるのですが、現在のiPS細胞由来の細胞はそこまで再現できていません。近い将来、漠然とした光が分かる、ものの形が分かる程度にはなるかもしれませんが、まだまだ実現には難しいのが実情です。そもそも網膜の視力を司る黄斑がどのようにできるのか、解明されていないことが多く、培養の過程で何かの偶然をきっかけに黄斑を作製できるかもしれませんが、道筋が見えているわけではありません。視細胞の再生には、解明すべき課題が山積しているのです。
さらに2021年に入り、他人由来のiPS細胞から作った健全なRPE細胞を、バラバラの状態で含む液体のRPE細胞懸濁液にして、RPE細胞が失われて薄くなった網膜の下に移植する臨床研究をスタートさせました。移植の対象疾患を拡充し、新しい治療法の有用性や安全性の確認を目的に、50症例に移植し、1年間観察する予定です。その1例目の手術を、今年3月、RPE不全による網膜色素変性症のために視力が低下した40代男性に実施しました。視細胞のメンテナンスを担うRPE細胞が拒絶反応なく生着できれば、視細胞が保護されることが期待でき、次のステップへの大きな足がかりになるであろうと考えています。
実現への険しい道のりを切り拓いていく
網膜色素変性症は、病院で行える治療は残念ながらなく、1年に1回程度受診していただき、視力検査や視野検査で進行を見定めます。また、合併症にも注意しています。一番多いのが白内障で、網膜色素変性症の進行スピードと比例して発症し、一般的な発症年齢が60~70代であるのに対し、この疾患では早いと20代で発症することもあり、白内障の手術を40~50代で行う患者が多いのです。
同時に、「ロービジョンケア」という残された視力を効率的に利用して日常生活を快適に過ごせるような指導や援助を行っています。錐体の働きが弱くなったときに感じるまぶしさを抑える遮光眼鏡、文字を見やすくするルーペや拡大読書器、コンピュータの音声ソフトなどの使用を紹介したり、どのように進行していくのかなど、将来の見通しについて相談を行っています。
私たち研究グループが行う網膜の再生医療だけでなく、人工網膜や遺伝子治療などの新しい治療法の開発や実用化に向けた臨床研究が、国内外の研究機関等で進んでいます。患者それぞれの病気の進行スピードに合わせて、新しい治療法を選択できるようにすることが重要だと考えています。
患者には、「何年後に字が読めるようになるか、人の顔が分かるようになるかは、今の時点で見通しは立っていないけれど……」と前置きしたうえで伝えていることがあります。今、行っている臨床研究で、光が感じられることの証拠を示すことができれば、さらに網膜を構成する細胞の仕組みの解明や、移植する細胞の状態などの技術的な改良を進めることができて、もう少しものの形が分かるぐらいの視力の回復につながるかもしれないと、お話ししています。そして、10年前、20年前に比べれば、網膜色素変性症をはじめとする難病の新規治療法開発は、世界中の研究者の努力で飛躍的な進歩を遂げており、実用化が間近な治療法もあるという期待感を患者と共有しています。ですから、「治療が受けられるように、諦めず、健康で元気に過ごして長生きすれば、治療のチャンスがあるかもしれません」と伝えていきたいと思います。