がん遺伝子の解析が薬物治療を劇的に変えつつある。臓器ごとに一様に使われていた細胞障害性抗がん剤はその後、原因となる遺伝子の検査で細分化されて有効性が増し、進行期のがんにも大きく貢献している。現在は、次世代シーケンサーを用いて大量の遺伝子を解析し、最適な薬を探し出す「がん遺伝子パネル検査」が開始され、治療の選択肢が増えている。今のところ適合する薬は十分ではなく、費用と時間がかかるなど課題も多いが、治療効果向上が期待されている。
〈シリーズ〉がんから身をまもる
第3回 転換期を迎えた「薬物療法」 ゲノム解析で有効な薬を探す「パネル検査」への期待と課題
構成/飯塚りえ
がんの治療には、がんを切除する外科的手術、がんの部分に放射線を照射する放射線療法、それに薬物療法があります。薬物療法では現在、がん遺伝子(ゲノム)を用いて治療法を検討することが多くなってきました。
バイオマーカーに基づく「個別化医療」
薬物療法の中で最も長い歴史があり、広く使われているのは、細胞障害性抗がん剤です。第一次世界大戦でドイツが使った毒ガスが、1946年ごろに白血病の治療に有用であることが分かり、それが抗がん剤の開発につながりました。その後、現在までの80年ほどの間に、多くの種類の抗がん剤が開発されています。
抗がん剤は一般的に、胃がんはこの薬、肺がんはこの薬、というように、がんの種類に応じて使います。しかし、2000年ごろから遺伝子などのバイオマーカー(疾患の有無や病状、薬の効果などの目印となる生体内の物質)に基づく「個別化医療」というキーワードが登場します。
まず、乳がんでHER2というタンパク質が注目されるようになりました。これは細胞の増殖に関わるタンパク質で、一部の乳がん細胞の表面に多く出現することが確認されたのです。このタイプを「HER2陽性乳がん」といい、乳がん全体の15~20%を占めます。
このタイプの乳がんに対して、ハーセプチンという薬の効果が高いことが分かり、これが、患者にどの薬が有効かを調べるためのバイオマーカーとして利用されるようになりました。
次に、研究が進んだのがEGFR遺伝子です。私は、呼吸器系を専門としているので、肺がんで説明したいと思います。
遺伝子に着目する以前、肺がんは、顕微鏡で形状を見て、小細胞がんとそれ以外の腺がん、扁平上皮がんなどに分類されていました。
しかし、1987年には肺がんとKRAS遺伝子の関連が、続いてEGFR遺伝子との関連が示されました。KRAS遺伝子に対して有効な薬は開発されないままでしたが、2002年ごろ、EGFRタンパク質を標的としてイレッサという分子標的治療薬が発売されました。それまで、肺がんには、遺伝子変化に関係なく、カルボプラチンとパクリタキセルといった細胞障害性抗がん剤が使用されていましたが、イレッサはEGFR遺伝子に変異がある患者に特に有効だったことから、EGFR遺伝子の患者をグループ化すること、ひいては、遺伝子に基づいた治療を検討することの有用性が明らかになったのです。
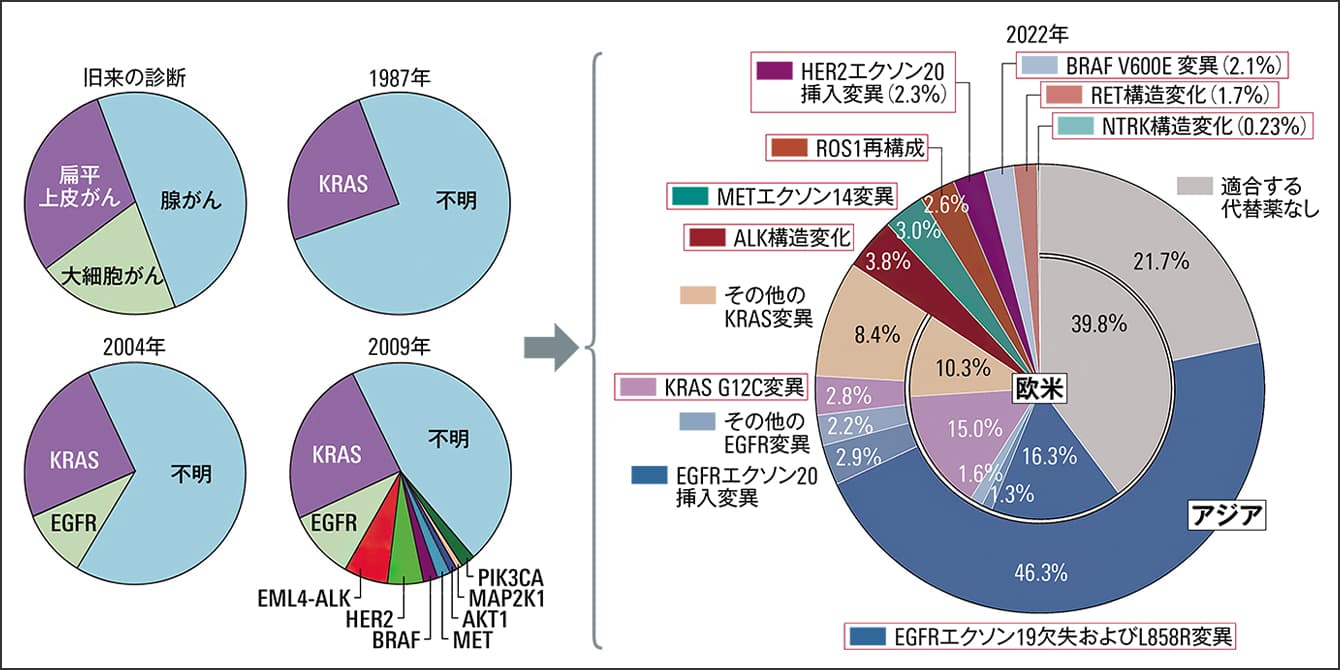
遺伝子をバイオマーカーとする考えは、それまでのがん治療を大きく変化させました。2007年、EML4-ALK融合遺伝子の発見などを経て、現在は、がんの発生に関わる多くの遺伝子が発見され、またそれに対する薬も開発されています(図1)。
 Pao W, et al. Lancet, 2011., Tan.AC, et al. J Clin Oncol, 2022.より改変
Pao W, et al. Lancet, 2011., Tan.AC, et al. J Clin Oncol, 2022.より改変
図1 肺がん(小細胞がん以外)のドライバー遺伝子の変異肺がんは最初にドライバー遺伝子(がんの発生や進行に直接的に関与する)という概念が実用化されたがん。形態学的な分類をしていた時代を経て、1987年にKRAS遺伝子が発見されたが阻害薬の開発は難航している。2004年にEGFR遺伝子が発見され、薬の開発が進む。2022年には右表のように分類されている。赤枠が適合する薬剤のある遺伝子。内枠は欧米人、外枠はアジア人で、原因遺伝子には人種差がある。
固形がん(血液以外の臓器で発生するがんの総称)の中で、肺がんは、最初に遺伝子による薬物療法の効果が示され、その結果、薬の開発も最も成功しているがんの一つです。肺がんには、図1のような精密な図があり、対応する薬も開発されていますが、一方ですべての肺がん患者で遺伝子に対応した薬があるわけではなく、今後の研究課題です。
有効な薬を探すがん遺伝子パネル検査
がん治療においては今、「がん遺伝子パネル検査」と呼ばれる検査が行われています。これは、患者のがん関連遺伝子を一度に大量に調べて有効な薬を探すことを目的としています。パネル検査に至るまでにいくつか段階がありますので、まず、がんの薬物療法における遺伝子の利用について、やはり肺がんを例に、見てみましょう。
肺がんと診断された場合、組織診断(顕微鏡での形態的な診断など)とともに、肺がんで変異があることが多く、治療薬に結びつきやすい10種程度の遺伝子やPD-L1(がん細胞の表面に現れているタンパク質)の発現の有無などを調べて、治療の方針を決め、使用する薬剤を検討します。
そして標準治療(効果と安全性が確立している薬物療法)を行いますが、薬物療法では、がんの根治は難しいため、治療の選択肢をできるだけ増やす必要があります。そのために行うのが、パネル検査です。
パネル検査は、がん組織や血液からDNAなどを取り出して、がんに関連する遺伝子に変異があるかどうかを解析するもので、2019年から、標準治療が終わった、または終わる見込みの方で、一生に1度、保険適用で検査が受けられるようになりました。
パネルとは、検査の対象となる遺伝子のセットを指します。次世代シーケンサーという機器を使って、一度に700もの遺伝子を解析するようになってきました。多くの遺伝子を対象とするパネル、生殖細胞系列の遺伝子を検査するパネル、RNAの変異も見るパネルなど、パネルの設計は、機器を提供するメーカーによって若干異なります。
| 変異・増幅対象遺伝子 (124遺伝子) |
融合対象遺伝子 (13遺伝子) |
|||||||
| ABL1 | BCL2L11/BIM | DDR2 | GNAQ | MAP2K2/MEK2 | NF2 | PIK3R1 | SETBPT | AKT2 |
| ACTN4 | BRAF | EGFR | GNAS | MAP2K4 | NFE2L2/Nrf2 | PIK3R2 | SETD2 | ALK |
| AKT1 | BRCA1 | ENO1 | HRAS | MAP3K1 | NOTCH1 | PMS2 | SMAD4 | BRAF |
| AKT2 | BRCA2 | EP300 | IDH1 | MAP3K4 | NOTCH2 | POLD1 | SMARCA4/BRG1 | ERBB4 |
| AKT3 | CCND1 | ERBB2/HER2 | IDH2 | MDM2 | NOTCH3 | POLE | SMARCB1 | FGFR2 |
| ALK | CCNE1 | ERBB3 | IGF1R | MDM4 | NRAS | PRKC1 | SMO | FGFR3 |
| APC | CD274/PD-L1 | ERBB4 | IGF2 | MEN1 | NRG1 | PTCH1 | STAT3 | NRG1 |
| ARAF | CDK4 | ESR1/ER | IL7R | MET | NTSC2 | PTEN | STK11/LKB1 | NTRK1 |
| ARID1A | CDK6 | EZH2 | JAK1 | MLH1 | NTRK1 | RAC1 | TP53 | NTRK2 |
| ARID2 | CDK12 | FBXW7 | JAK2 | MSH2 | NTRK2 | RAC2 | TSC1 | NTRK3 |
| ATM | CDKN2A | FGFR1 | JAK3 | MSH6 | NTRK3 | RADSIC | TSC2 | PDGFRA |
| AXIN1 | CHEK2 | FGFR2 | KDM6A/UTX | MTAP | PALB2 | RAF1/CRAF | VHL | RET |
| AXL | CREBBP | FGFR3 | KEAP1 | MTOR | PBRM1 | RB1 | ROS1 | |
| B2M | CRKL | FGFR4 | KIT | MYC | PDGFRA | RET | ||
| BAP1 | CTNNB1 | FLT3 | KRAS | MYCN | PDGFRB | RHOA | ||
| BARD1 | CUL3 | GNA11 | MAP2K1/MEKT | NFT | PIK3CA | ROS1 | ||
上記の表には、124遺伝子の変異や増幅、13遺伝子の融合を検出する際に対象としている遺伝子が挙げられています。これを見ると、現時点で対応する治療薬があるとされる、赤い枠の遺伝子は残念ながら多くありません。青い枠は、臨床試験で効果や安全性が確認された治験薬があるものです。その他は、がんに関与する遺伝子ですが、治療薬はまだ研究途上にあります。
これらの解析結果はレポートとして担当医師に提供されます。それを基に、エキスパートパネル協議といって専門家が治療法を協議し、適した治療を提案します。
適合する薬が見つからない可能性も
患者にとって、がん遺伝子パネル検査の最大のメリットは、治療の選択肢を増やすことです。
肺がんの治療において、イレッサが登場する以前には、Ⅳ期の患者は余命半年と言われることもありました。しかし、遺伝子などのバイオマーカーに基づく治療が行われるようになり、何年もがんと共生している患者もいます。
私が知る例では、肺がんと診断されてから10年以上存命している患者がいます。EGFR遺伝子に対する薬物療法を行った後、従来の抗がん剤を使用するなどして標準治療を終え、パネル検査を行いました。そこで特定の遺伝子が検出されましたが、偶然にもその遺伝子に対する薬剤の臨床試験が始まったときで、その薬剤を使って治療を続けました。時間とともに新しい薬剤が開発されますし、がんの原因となる遺伝子は、治療の影響を受けてしばしば変容します。検査によってそれが明らかになり、新しい治療目標が見つかることもあるのです。
パネル検査の結果、ぴたりと適合する薬が見つかることが患者にとって最善ですが、先にも触れたように、残念ながらまだ薬が十分にそろっているとはいえません。この検査を受ける際、患者は医師からの説明により「適合する薬が見つからない可能性もある」ことをデメリットとして知らされます。実際、国立がん研究センターで掲出している実績では、パネル検査を受け、実際に薬物での治療につながった患者は12%程度とされています。
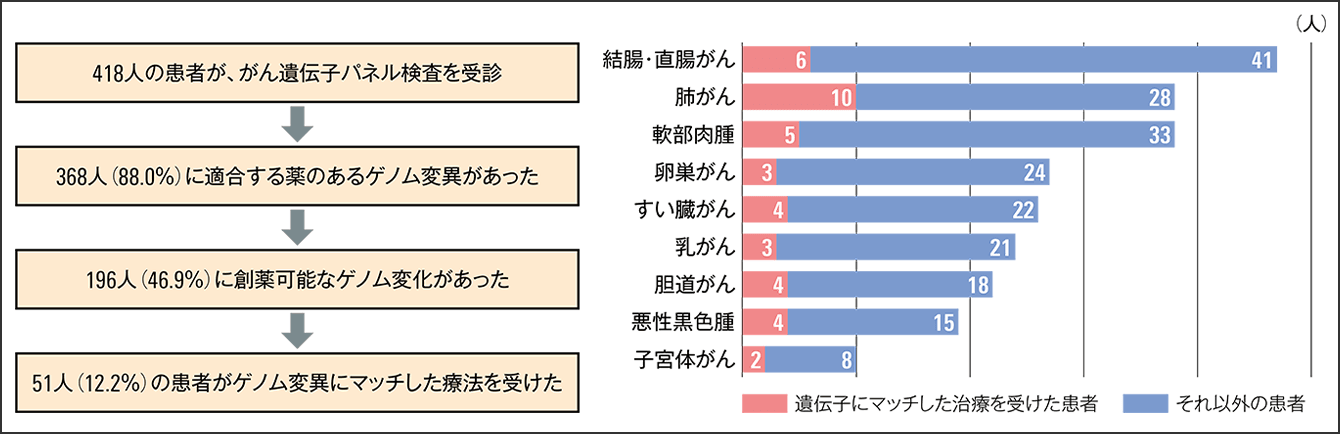
しかし、少し詳しく数字を見ていくと、違う様子も見えてきます。図2を見ると、検査によって、88%でがんの原因遺伝子が特定され、12%が遺伝子のレベルでは原因が不明となります。次の段階では、遺伝子の変異から鑑み、全体の50%ほどで有効な薬剤が提案されています。しかし、最終的に薬物療法に至るのは12.2%の患者でした。
 Ida H, et al. Cancer Sci, 2022.より改変
Ida H, et al. Cancer Sci, 2022.より改変
図2 がん遺伝子パネル検査の結果国立がん研究センター中央病院で標準治療後にがん遺伝子パネル検査を受けた418人のうち、肺がん患者は38人。そのうちの26%が遺伝子にマッチした治療を受けた。また、肉腫38人など、さまざまながんの患者のうち、46.9%の患者で有効とされる薬が提案されている。しかし、それ以外の条件によって、実際に治療にまで至る割合は12.2%となっている。
より個別化された治療を提供する
薬物療法には、「毒を以て毒を制す」という側面があり、副作用が起きる可能性があるため、患者の状態を見ながら治療を行います。主治医は、がん遺伝子パネル検査を受けるときには、薬物療法に耐えられると判断するのですが、がん以外に、心臓や肺、肝臓、腎臓などの臓器に不調を抱えている進行期の患者は少なくありません。検査の結果を待っている1カ月ほどの間に病状が劇的に悪化してしまい、遺伝子に合致した薬剤が見つかっても治療が実施されないままでいるケースがあります。そのような状況がこの結果に影響している可能性も想定できます。
そのため、パネル検査をもっと早い段階で行うべきではないかと議論されています。がんと診断された時点で、パネル検査を行えば、多くの患者の治療につながる可能性はあります。しかし、エキスパートパネル協議は、10人ほどの専門家が参加し、レポートの情報を多方面から吟味するべく、数十時間をかけて行っています。パネル検査は費用と労力を多く必要とし、がん診断の最初のステップに組み込むことは、容易ではありません。
パネル検査ではまた、知りたくない情報を知ってしまうことがあります。対象とする遺伝子の中には、生殖細胞系列遺伝子といって、自分のがんが次世代に遺伝する可能性があるものも含まれています。つまり、検査の結果は、患者自身だけでなく、子どもや家族にも影響を及ぼすことがあるのです。このような情報は非常にセンシティブで、検査を行う前の同意書でも、生殖細胞系列遺伝子に関しては知りたくない、という選択肢が用意されるなど、慎重に対処しています。また、遺伝する可能性のある遺伝子変異に該当した患者には、確認のための追加の検査を行い、遺伝外来のサポートを徹底しています。
がんゲノム医療の背景には、「プレシジョン・メディスン(精密医療)」や「個別化医療」があります。2つの言葉の定義は若干異なるものの、共に患者個人の遺伝子や生活習慣、病気のなりやすさなどに基づいて、より個別化された治療を提供することを目指しています。がんの薬物治療に関しては、適切な薬を適切な患者に使って治療をすることが重要です。ゲノム医療が、そのまま個別化を指すものではありませんが、個別化医療を目指す中で、がんにおいてはゲノムが良い指標になると考えられます。
また、がんの遺伝子変異は、人種による差があるため、日本でパネル検査を積極的に行うことには、日本人のデータを蓄積するという重要な意義もあります。
図1で見たように、アジア人の肺がんの約50%にEGFR遺伝子の変異が見られるのに対して、欧米人は20%程度と大きな差があります。今、世界にある遺伝子のデータベースは、主に欧米中心ですが、アジア独自のデータは、今後新しい治療薬を開発していくうえで必須です。日本のがん治療に役立つデータを収集し、今後の治療開発に活用することも、パネル検査の重要な側面と考えています。