ネコに頻発する慢性腎臓病は、はっきりとした原因が分からず、完治は不可能とされてきた。しかしAIMというタンパク質が治療薬の鍵を握ることが分かってきた。AIMは、貪食細胞のマクロファージに死細胞などいわゆる体内の「ゴミ」を食べさせる役割を持ち、多くの動物では機能している。ところが、なぜかネコの仲間だけはAIMが活性化せず、その結果ゴミが腎臓にたまり腎臓病を引き起こす。AIMを投与することでマクロファージはゴミを貪食し、腎機能が改善する。
特集 ペットと暮らす マクロファージに関与するAIM ネコを腎臓病から救うか!?
構成/菊地武顕 イラストレーション/千野六久
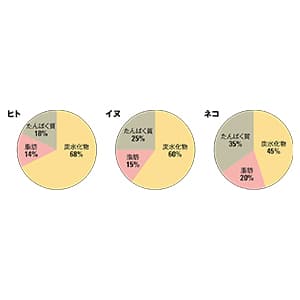
ほとんどのネコは老齢になると腎臓病にかかり、苦しんだ末に亡くなっていきます。人間同様、ネコにとっても、腎臓病は治せない病気とされてきました。ところが今、ネコの腎臓病治療薬の開発・治験が進行中で、順調にいけば来年度、遅くても再来年度には承認申請を出せるところまできています。
ネコのAIMは活性化していない
治療薬に用いられるのは、AIMというタンパク質です。このタンパク質は人間や動物の体内にあり病気の進行を防ぐ役割を果たしているのですが、ネコの場合は体内に持っていながらも、活性化しないまま腎臓病で亡くなっていくことが分かっています。夢の治療薬は、AIMを注射する、もしくは体内にあるAIMを活性化させることで、腎臓病を治そうというものです。
このAIMは1999年に、私が発見した分子です。HLA-DMという分子によってTリンパ球の選別が行われることを解明した私は、スイスのバーゼル免疫学研究所でHLA-DMに形状が似た新しい分子を見つけ出し、それがTリンパ球の機能に関与しているかどうかを調べる研究に従事していました。ところが、半年ほどかけて発見した新しいタンパク質はTリンパ球とは無関係なもので、体内にあるマクロファージ(貪食細胞の一つで、末梢組織に侵入した病原体などを食べる免疫細胞)を長生きさせるらしいことが分かりました。そこで私は、「Apoptosis Inhibitor of Macrophage(マクロファージの細胞死を抑制する分子)=AIM」と名づけたのです。
発見はしたものの、その働きは謎。AIMは血液の中にたくさん存在するのですが、体内でどういう働きをしているのか、まったく分かりませんでした。ずっと免疫学の第一線で研究をしてきましたし、免疫細胞であるマクロファージが産生するタンパク質ですから、何の疑いもなくAIMは免疫系に影響のある分子だと思い込んでいたのです。AIMを持たないノックアウトマウスを作成し、通常のマウスと比較したのですが、両者は、Tリンパ球の機能も他の免疫系の細胞の働きもまったく変わりませんでした。
AIMの働きを突き止めることができたのは、アメリカのテキサス大学に移ってからのことです。テキサス大学は肥満やコレステロールの研究では世界一といわれ、そうそうたる研究者がいました。ある日、ノーベル生理学・医学賞を受賞したジョセフ・ゴールドスタイン博士と立ち話をしたところ、AIMについて「免疫のほうからばかり研究をしているようだけど、肥満やコレステロールのほうからも実験してみては」と言われたのです。
そこでAIMを持たないノックアウトマウスを太らせてみたところ、AIMを持つ太ったマウスに比べ、肥満や脂肪肝が悪化しやすいことが分かったのです。動脈硬化巣(プラーク)にもAIMがたくさん集まっていることが分かりました。AIMは免疫に関係するものではなく、どうやら脂肪に関係する生活習慣病を抑制するものらしいと分かってきましたが、さらに脂肪肝から発生する肝臓がんまでも、発症を著しく抑える効果があることが分かったのです。
その後、腎臓の研究者の助言も得て腎臓病との関係について実験用マウスを使って調べてみると、急性腎障害が発症したとき、AIMが働いていないと急速に悪化して多くが腎不全で死亡してしまう。しかしAIMを注射すると、腎障害が急速に改善し治癒したのです。ということは単に脂肪に関係する分子ではない。もっと根本的なメカニズムがあると捉え研究を続け、「体内のゴミ掃除」こそがAIMの基本的な機能であるという点に行き着きました。
マクロファージはAIMを目印にゴミを食べる
肥満や脂肪肝などの生活習慣病にしても、腎臓病にしてもがんにしても、ウイルスなど外から入ってきたものによって引き起こされる病気ではありません。自身の体内にある細胞の死骸や壊れたタンパク質、あるいは過剰な脂肪などがうまく取り除かれないと、慢性的な炎症を引き起こし、病気は持続的に悪化していきます。がんでしたら、もともと我々の体内で働いていた細胞が何かの拍子にがん化してしまい、そのがん細胞が取り除かれないと増え続けて腫瘍になります。これもまた、本来取り除かれるべきゴミが体内に少しずつたまっていく病気といえます。
腎臓病の研究を進めるうちに、AIMは体内で発生するいろいろなゴミを片づけて、さまざまな病気の進行を止めている、非常に重要なタンパク質だということがはっきりしました。そのメカニズムもようやく解明できました。AIMは、ゴミをマクロファージに食べさせる働きをしているのです。
AIMは通常時、抗体の一種である免疫グロブリンM(IgM)に結合した形で、血液1㎖あたり約5μg存在しています(図1)。健康な状態では、IgMに結合することで不活性状態になっていますが、体内にゴミがたまってきますとAIMはIgMから離れ、ゴミのほうに結合します。AIMが結合することで、それ自体がゴミを分解するとか溶かすとかの作用があるわけではありません。結合したAIMを目印にマクロファージが寄ってきて、AIMと一緒にゴミを食べ除去するのです。AIMは通常IgMと結合していますが、IgMは非常に大きな分子なのでマクロファージが食べることはできません。
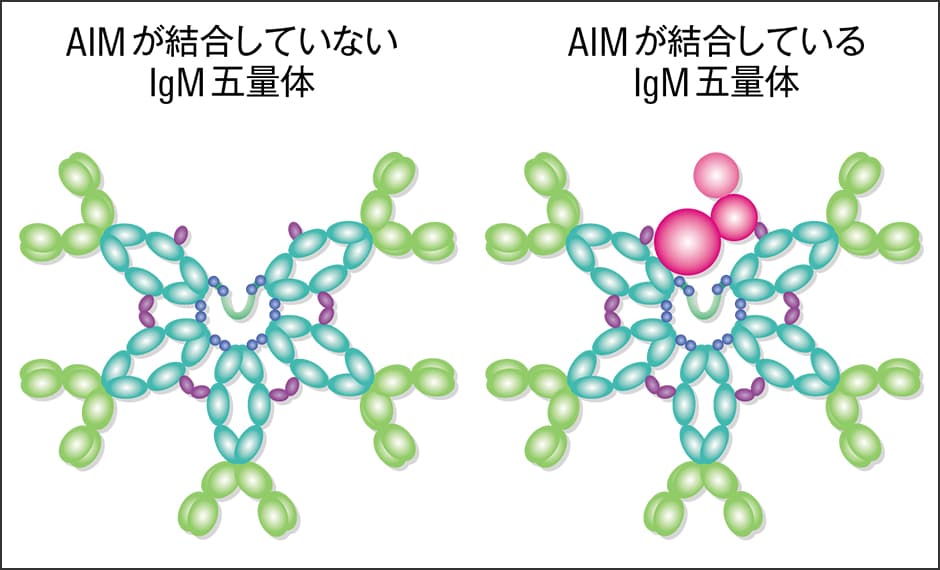
図1 AIMとIgM五量体AIMは血液中に単独で存在しているわけではなく、IgMが5つ組み合わさったIgM五量体と結合している。IgM五量体は、まるでAIMが組み込まれるスペースを用意しているかのような形をしている。
例えて言えば、AIMは粗大ゴミ収集の際のシールです。粗大ゴミを出すときにシールを貼ることで、ゴミ収集車の職員にこれはゴミであるから収集してほしいと知らせる。それと同じことが体内で起こっているのです。粗大ゴミのシールの粘着面は普段は台紙に貼りついていて、それを剥がしてゴミに貼りつけられます。それと同様に、AIMも普段はIgMという台紙に貼りついていますが、ゴミを見つけるとそこから剥がれてゴミに貼りつくのです。そしてAIMというシールが貼られたゴミだけを、収集車であるマクロファージが片づけてくれるわけです。
AIMがゴミに貼りつく工程を説明しましょう。通常、正常な細胞やタンパク質は、表面はプラス、もしくはプラスでもマイナスでもないニュートラルに荷電しており、細胞の裏側やタンパク質の内側がマイナスに荷電しています。細胞が死んだり、タンパク質が壊れたりすると、マイナスに荷電した側が表面に出てくるのです。その部分に、まずAIMのお尻側(C末端側)の表面にあるプラスに荷電した面がくっつきます。
“治らない病気”の原因はたまったゴミ
第2段階として、システインというアミノ酸が活躍します。通常、システインはタンパク質の中に偶数個あり、2個ずつがジスルフィド結合という強い結合でブリッジを作っています。例えばあるタンパク質の中に8個のシステインがあるなら、2個ずつ結合した4組のシステインがタンパク質の形を固める働きをしています。ところがAIMは非常に珍しいことに奇数個のシステインを持っているのです。そのため1個だけブリッジを作れないシステインがあり、それはAIMの表面に飛び出した形で存在します。一方で、ゴミというべき壊れたタンパク質は、タンパク質内部のジスルフィド結合が崩れてしまい、やはり単独のシステインが表面に現れます。細胞の死骸も表面のタンパク質が壊れてしまうことで、単独のシステインがむき出しとなります。AIM表面にあるシステインは、ゴミのむき出しになったシステインとジスルフィド結合を形成し、AIMとゴミとの間に強く安定した結合が成立します。
AIMの数がゴミに対して足りないと、食べられなかったゴミ(シールが貼られず回収されなかったゴミ)が少しずつたまっていき、いつのまにか体内がゴミ屋敷になっていく。これが、脂肪肝、腎臓病、がん、あるいはアルツハイマー病などの“治らない病気”の基本的な仕組みといえるでしょう。
人間の腎臓病を治すべくAIMについての研究を進めていたのですが、たまたま獣医の先生と話す機会がありました。そのときに「ネコはほとんど全員が腎臓病になります。イヌが腎臓病で死ぬ割合はだいたい人間と同じくらいですが、ネコが腎臓病で死ぬ割合は突出して高いのです。がんで死ぬネコもいますが、そのネコも多くは腎臓病に侵されています」という話を聞きました。すべてのネコが腎臓病になるということは、ネコの腎臓病が先天的なもの・遺伝病であることを示唆します。
もしかしたらと思い調べてみたところ、興味深い問題点が分かりました。ネコのAIMは、人間やイヌ、マウスなどのAIMとはアミノ酸の配列に特徴的な違いがあり、非常に強くIgMと結合しているのです。あまりに強く貼りついているため、腎臓にゴミが出てきても、IgMから剥がれてゴミと結合することができないのです。そのためAIMが貼られないままゴミがどんどんたまっていき、腎臓が慢性的に障害される、すなわち慢性腎臓病になってしまうわけです(図2)。
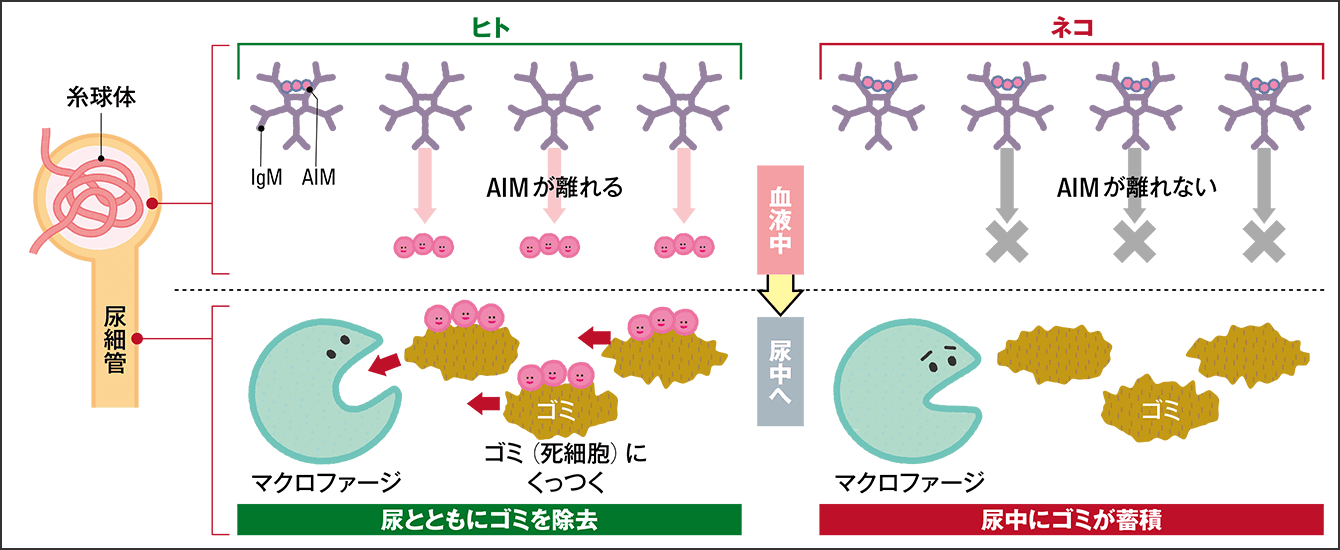
図2 AIMの働き(ヒトとネコの違い)ヒトの場合、血液中のIgMに結合していたAIMが離れ尿中に移動。尿細管を閉塞するゴミ(死細胞など)に結合。それをマクロファージが食べることで、ゴミは除去される。ネコのAIMはIgMから離れられないため、尿中のゴミは除去されず、たまり続けたゴミのために腎機能が低化する。
AIMが働かないから腎臓病になるのなら、当然AIMを補えば、腎臓病は治せるはずです。すでにゴミが腎臓にたくさんたまって病気が進んでいるネコに対しては、AIMを注射して強力にゴミ掃除をする必要があります(図3)。一方、まだゴミがそんなにたまっておらず病気が比較的初期の場合は、ネコ体内でIgMと結合したままのAIMを強制的にIgMから引き剥がして活性化することでゴミ掃除をさせることができるのではないかと考えました。研究の過程でL-システインというアミノ酸が、IgMから剥がさせる機能を持つことが確認されました。そこでL-システインを配合したペットフードを企業と開発し、2022年に世に出しています。日頃から食べさせることで少しずつたまるゴミを定期的に掃除する、いわば未病状態のネコのためのペットフードです。前述のようにAIM注射薬ももうすぐ承認申請を出せるところまできました。
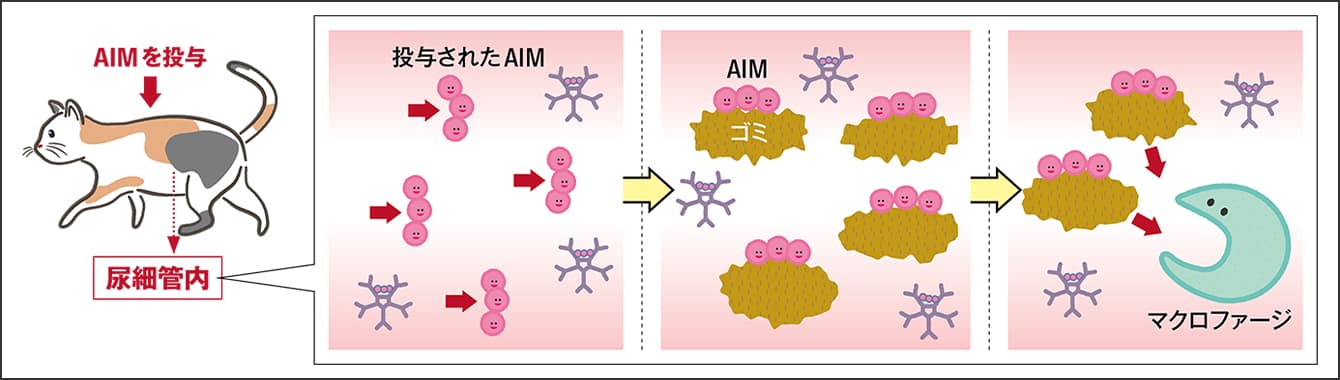
図3 ネコの腎臓病における治療の仕組み腎臓病が進行しているネコの治療としてAIMを注射すると、投与されたAIMは尿中のゴミと結合する。それを目印にマクロファージが寄ってきて食べることで、ゴミが除去される。これでゴミによる尿細管の閉塞が改善され、腎機能が上向く。
AIMがうまく働かず多くが腎臓病で死ぬのは、ネコだけではありません。ライオン、チーター、ヒョウなどの大型ネコ科動物も同様なのです。特にチーターは寿命が短く、ほとんどが8年程度で腎不全で亡くなるため、現在は絶滅が危惧されています。こうした大型ネコ科動物に対してもAIMで寿命を伸ばし、絶滅の危機から救うことが期待されています。もちろん、人間の腎臓病についてもAIMを用いた治療薬を開発しており、ネコ用治療薬から約1年遅れで開発が進んでいます。
活性化AIMの増加は病気のサイン
またAIMは、腎臓に関するゴミだけではなく、体内のいろいろな臓器にたまるさまざまなゴミ全般の掃除に関わる働きをすることが判明しています。今は腎臓病治療薬の開発が進んでいますが、これが完成し承認されれば、脂肪肝・肝臓がん、関節リウマチ、尿路結石、多くの脳神経疾患の治療にも期待が寄せられます。
すでに、脳梗塞を起こしたマウスにAIMを注射すると脳内のゴミ掃除ができるために死亡率が劇的に低下することが実証され、2021年に論文化しています。これから考えると、慢性的にゴミがたまっていくことで起きるアルツハイマー病、パーキンソン病などにも応用できる可能性があると思います。ただし脳は、雑多なタンパク質が侵入しないように血流脳関門と呼ばれるバリアーで守られています。そこをどう越えて脳に届けるかという問題が残っていますが。
血液の中で、どれくらいAIMがあるかを測定する方法も確立されました。それを用いて長崎県の病院が検診に来た約2万人を対象に調査したところ、明らかに性別・年齢で差があり、10代・20代の女性が最も多くAIMを持っていることが分かりました。年を重ねるごとにだんだん減り、閉経が始まる時期で男女での差がほとんどなくなります。エストロゲンなど女性ホルモンと関係があるのかもしれませんが、そのあたりはまだ解明できていません。
健康な状態ですとAIMはIgMと結合しており、ゴミが体内にたまっている人はAIMが活性化しているわけです。逆に言うと、活性化したAIMがたくさんあるということは、何か病気が始まっているサインです。活性化したAIMの量を測ることで、病気の早期診断ができるのではないかと考え、前述の長崎の病院と1年前から共同研究を行っています。通常の健康診断で採血した血液を用いるわけですから、被験者に余計な負担はかかりません。健康診断においてAIMの測定も行えるようになり、いろいろな病気が早期診断できるようになれば、病気の治療率が上がることが予想できます。AIMをうまく使って健康寿命を伸ばす。その期待が高まっています。