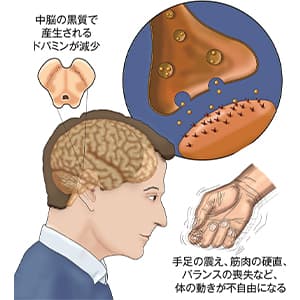
脳が発した筋肉を動かす指令は、脳幹や脊髄を通って各筋肉に伝わるが、この経路(運動ニューロンと呼ばれる)が損なわれると筋肉は萎縮し、全身の筋力が低下して運動麻痺を起こす。ALSと呼ばれる筋萎縮性側索硬化症は進行性で、呼吸や嚥下に関わる筋肉にまで及ぶと、人工呼吸器や胃ろうに頼らなければ命に関わるという。根治がかなわない難病だが、進行抑制が期待される新薬や、より効果的なリハビリ法も開発されており、治療法は進化している。
「神経難病」の最新治療 筋肉が萎縮する難病ALS 克服を目指す多様な治療法
構成/渡辺由子 イラストレーション/千野六久
私たちが体を動かすとき、その指令は大脳皮質の運動野から、運動をつかさどる神経細胞(運動ニューロン)を介して、脊髄を通って筋肉に伝えられることで、手足を曲げたり、会話したり、食べ物を飲み込んだりできます。運動ニューロンは、脳から脊髄をつなぐ上位運動ニューロンと、脊髄から筋肉までをつなぐ下位運動ニューロンがあり、体の動きは、上位から下位への伝達がリレーのバトンパスのようにスムーズに行われることで成り立っています。
50~70歳で発症することが多い
ALS(Amyotrophic Lateral Sclerosis:筋萎縮性側索硬化症)は、全身の筋力の低下(運動麻痺)と筋肉の痩せ(筋萎縮)が生じる、進行性の疾患です。しかも、多くのALSでは意識は清明で、感覚は正常に保たれます。原因は筋肉ではなく、脳から筋肉を動かすために指令を伝える上位運動ニューロンと下位運動ニューロンが変性し、消滅するためです(図1)。
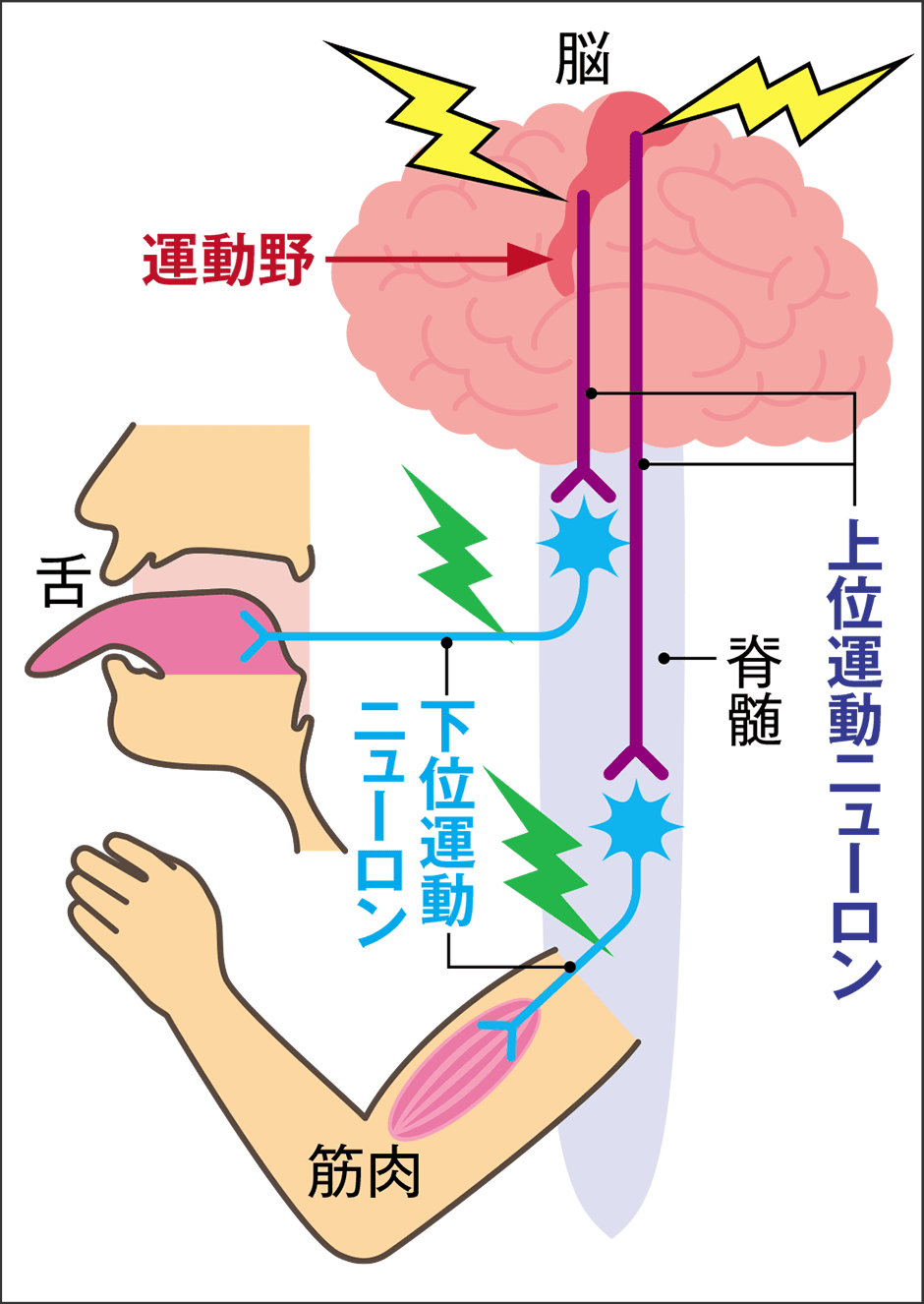
図1 運動ニューロンと筋肉体を動かすには、脳からの指令を脳幹や脊髄に伝える上位運動ニューロンと、脳幹や脊髄から筋肉に伝える下位運動ニューロンのスムーズな連携が重要。ALSでは、上位や下位の運動ニューロンの障害により、運動麻痺や筋委縮などが起こる。
運動麻痺や筋萎縮が進み、呼吸や嚥下に関わる筋肉にまで及ぶと、酸素や栄養を取り込むことができなくなり、人工呼吸器の装着や胃ろうの造設をしなければ、命に関わります。ALSの寿命は、人工呼吸器や胃ろうに頼らず自然に任せた場合、発症から3~4年です。
50~70歳で発症することが多く、高齢化の進む日本では徐々に患者数が増えており、現在の患者数は約1万人です。男女比は、男性のほうが約1.5倍多く認められています。
患者の90%以上は遺伝とは関係なく発症する孤発性で、遺伝と関係のある家族性ALSは10%以下です。家族性ALSでは、原因と考えられる遺伝子の変異が30~40種で見つかっており、なかでもわが国では、「スーパーオキシド・ジスムターゼ(SOD1)」という活性酸素を解毒する酵素をつくる遺伝子の変異が、家族性ALSの約30%に見つかっています。孤発性ALSについても、TDP-43という病気の原因となる異常タンパク質が発見され、さまざまな病態が解明されつつあります。このように、ALSはいまだ根治療法のない難病ですが、原因不明の疾患ではなくなってきています。
運動麻痺や筋萎縮が全身の筋肉のどこから始まるか、ALSの初期症状は患者によって異なりますが、「体重減少」はALS患者のほとんどに見られる症状です。原因としてエネルギー代謝が亢進するためと考えられていますが、詳しいことは分かっておらず、現在盛んに研究されています。さらに、ALSではTDP-43が、脳のさまざまな場所に蓄積することが麻痺に関係していると考えられていますが、特に最近の研究では、TDP-43が摂食や食欲、呼吸などに関わる自律神経の総元締である視床下部に蓄積することが体重減少につながるという説が有力です。
複数の部位で筋肉がピクピク動く
次に挙げる症状は、受診のきっかけになる特徴的なもので、体重減少に加えて確認できることは、診断のうえでも重要になります。
筋肉がピクピク動く「筋線維束性収縮」は、ALSでは力を入れているときや脱力しているときに関係なく、間欠的に複数の部位で起こるもので、脊髄の運動ニューロンが消滅していくときに、異常な信号が筋肉に伝えられて生じます。ALS患者では頻繁に確認できる症状ですが、正常でも認めることがあるので専門医の判断が必要です。
上位運動ニューロンに障害が起こると筋肉の緊張が高まり、四肢が突っ張ったようになります。下位の場合は緩んだ状態になることから、運動ニューロンの障害が、上位で起きているか、下位で起きているかを見極める重要なポイントです。
手のひらの親指のつけ根の盛り上がりや、人差し指の親指側との間の第1背側骨間筋が、そがれたように痩せるのも特徴です。ペットボトルや缶を開けることが難しくなります。
筋肉でできている舌は、痩せていくと表面のシワが目立ってきます。舌の厚みがなくなり、凸凹の溝が深くなると、会話や嚥下がかなり不自由になります。
球麻痺は、口・舌・喉に起こる運動麻痺で、舌の痩せにも関わり、構音障害や嚥下障害が現れます。呼吸筋の麻痺が起こると、息切れや呼吸困難が生じます。
病状の進行は、初期症状の現れ方による傾向が確認されています。手の症状から始まるケースでは比較的進行が遅く、高齢で発症し、症状が口の中から始まるケースでは進行が早い傾向にあります。
ALSの診断は、「除外診断」が基本です。ALSとよく似た症状が現れる疾患、特に治療可能な疾患をしっかりと除外し、経過と検査結果からALSが最も疑われる疾患として残るときに、「ALSである」と診断します。また、画像や血液、髄液などの検査で、「この異常が見つかればALSである」「ALSの可能性が高い」という診断マーカーはありませんが、家族性ALSの遺伝子に突然変異を認めた場合は、ALSと診断します。
そこで、ALSを疑った際に脳神経内科で行う検査として、まず筋肉の萎縮や筋力低下の原因が筋肉ではなく、運動ニューロンにあるのか、さらに神経障害が現在も進行性であるのかを確認する「筋電図」、治療可能な脱髄疾患を除外する「神経伝導検査」、筋線維束性収縮を確認できる「筋エコー」などを行います。また、他の治療可能な疾患を鑑別する、「腰椎穿刺」「脳脊髄MRI」「血液検査(ガングリオシド抗体など)」を行います。
ALSは早期に診断を行い、早期に治療を開始することが望ましいですが、課題が2つあります。1つ目は自覚症状をきっかけに脳神経内科を受診する人が非常に少なく、手足の症状が強いので整形外科や脳外科、口の中の症状では耳鼻咽喉科、体重減少からがんを疑って内科や総合診療科などを受診することで、診断が遅れるケースが多いことです。
東邦大学医学部脳神経内科の研究チームによる論文があり、2000年代初めごろにALSの患者が脳神経内科を受診するまでにどのくらい時間が経過したかを調査。平均1年半経過していたことを報告しています。同科では14、15年後に同様の調査研究を実施し、その結果もやはり約1年半でした。神経内科医のALSを診断する技術は向上しているものの、十数年経過しても同じような結果になり、一般市民へALSの認知度を高めるとともに、診療科の垣根を越えた情報交換、情報共有の必要性を痛感しています。
2つ目が、ALSは厚生労働省の「指定難病」の一つで、申請が受理されると、治療費や検査費用の補助が受けられますが、現在用いられている診断基準では、上位運動ニューロンの症状がないとALSと診断できないことです。たとえ専門医が確定診断しても、症状の重症度が軽度であると、受給証の交付が受けられないケースがあります。今後の課題として、早い段階のALSを拾い上げることや、近年、日本の脳神経内科医を含む国際的な会議で提唱されたGold Coast基準という新しい診断基準が、わが国の難病申請の際の診断基準として、利用可能になることが求められます。
体重減少はALSの進行と死期を早める
現在のALSの治療は、薬物治療と非薬物治療が行われ、どちらも早期からの開始が重要です。薬物治療で使える薬剤は、「リルゾール」と「エダラボン」の2種類です。リルゾールは神経細胞を保護する働きがあり、18カ月間の投与で生存期間を2~3カ月延長できる効果が認められている一方、症状の進行抑制効果は証明されていません。エダラボンは脳梗塞急性期の薬剤で、ALSについても効果の確認をするために日本主導の治験を行い、症状の進行抑制効果が認められました。一方、生存期間の延長効果は証明されていません。
2024年9月ごろには、日本発の第3の薬剤「高用量メチルコバラミン」が承認される見通しで、薬物治療の選択肢が広がると期待されています。他にも、ALSの遺伝子治療として初めて開発された「トフェルセン」は、アメリカで2023年4月に承認。家族性ALSの原因遺伝子のSOD1に直接作用する核酸医薬で、病気の進行を抑制する効果が認められており、日本でも発売が待たれています。
今後に期待するALS創薬としては、孤発性ALSに対する核酸医薬や、アルツハイマー型認知症の「レカネマブ」同様、TDP-43に対する抗体医薬があります。さらに、日本人は海外と病気の遺伝背景や病態が異なる可能性もあり、日本独自のALS創薬活動が盛んになることを期待しています。
非薬物治療の要は、「高カロリー栄養」「呼吸療法」「リハビリ」の3つで、科学的なエビデンスを積み重ねて進歩を続け、生存期間が1年以上延びるケースも報告されています。
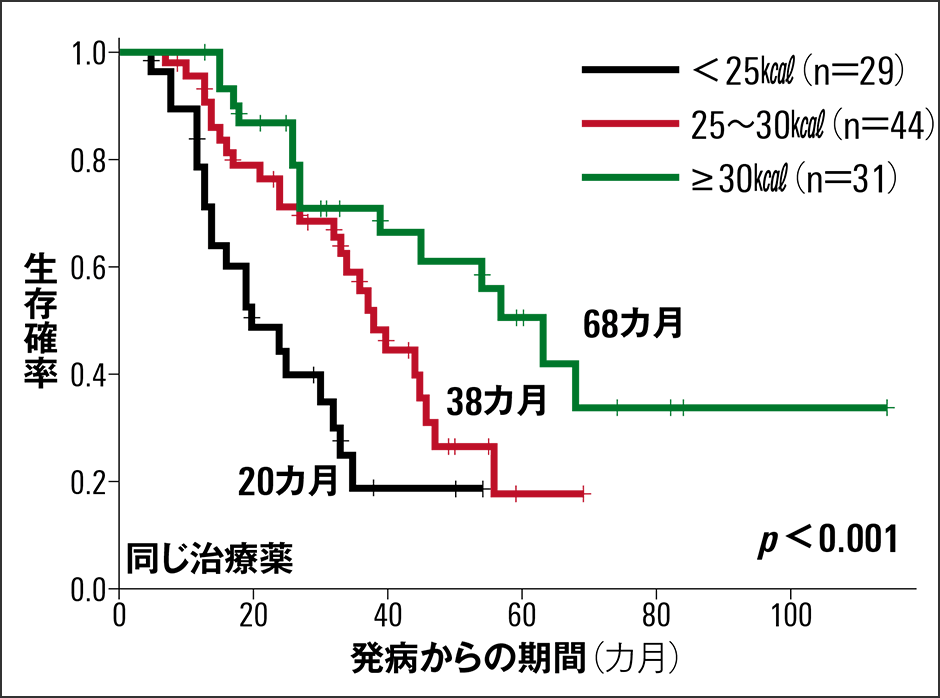
体重減少はALSの進行と死期を早めるとされ、栄養摂取は非常に重要で、特に高カロリー栄養はALSの一つの治療と考えていただきたいと思います。滋賀医科大学脳神経内科の研究グループでは、ALS患者の適正エネルギー量について論文を発表。2016〜2022年の104例で、標準体重(身長〈m〉×身長〈m〉×22)当たりのカロリー摂取と寿命を調査し、食べられるケースでは寿命が延びていることを確認。1日に必要な適正エネルギーは、「標準体重×25㎉以上」であることを報告しました(図2)。栄養摂取について、摂食・嚥下機能が低下した場合は発症後早期であっても胃ろう造設を検討しますが、その理由は経口摂取のみでは栄養不十分な体重減少とそれによる病気の進行の抑制を期待するためです。
 Nakamura R, et al. Front Neurol, 14: 1286153, 2023.
Nakamura R, et al. Front Neurol, 14: 1286153, 2023.
図2 標準体重当たりのカロリー摂取量と寿命体重減少はALSの進行と死期を早めるとされ、高カロリー栄養はALSの治療だ。滋賀医科大学脳神経内科の研究グループが、標準体重当たりのカロリー摂取量と寿命について調査。高カロリー摂取群の寿命が延びていることを確認した。
呼吸療法も非常に重要で、呼吸筋の麻痺による有効換気不全やCO2の蓄積、球麻痺における誤嚥性肺炎や窒息のリスクがあります。早期から呼吸機能や嚥下状態や呼吸数を観察したり、嚥下機能低下により唾液の飲み込みが困難になってむせやすくなるので、流涎対策も重要です。自力での十分な換気ができなくなった場合、人工呼吸器の導入を検討します。ここで強調したいのですが、人工呼吸器には鼻や口にマスクをあてる「非侵襲的」な方法と、気管に開けた穴に気管カニューレというチューブを入れる「侵襲的」な方法があることを知っていただきたいと思います。有効な自発呼吸が残っている段階であれば、鼻マスク形の「非侵襲的陽圧換気(NPPV)〈通称BiPAP〉」、有効な自発呼吸がない段階では、NPPVでは有効な呼吸サポートが得られないため、気管を切開して人工呼吸器を装着する「侵襲的陽圧換気(TIV)」の導入について、患者や家族と相談します。
早期診断と多職種の専門家による治療介入
BiPAPは早期から導入することで、生存期間の延長を確認したエビデンスがあり、推奨されています。TIVを装着すると、呼吸機能は完全に機械によってサポートされるので、呼吸苦から解放され、心肺機能は維持されます。しかしその一方で、声が出なくなるので、会話以外の意思伝達の方法をとる必要が出てきます。さらに体の不自由さは進行し、一部の患者はすべての筋肉を動かすことが困難になる場合があります。そのため、気管切開を選択した後に予想される症状や、必要なケアなどの情報について、主治医から十分な説明が必要です。コミュニケーションの手段を確保することは、ALS患者の生活の質を維持するために最も大切です。手足が完全に麻痺し、キーボードやボタンが使えない場合でも、眼球運動が保たれていれば文字盤や、視線入力装置でパソコンを操作して意思の疎通が可能です(図3)。症状の進行とともに、どうしても介護の負担は増えることが多いです。特に、高齢患者では老々介護となるケースがあり、社会資源を活用したサポートを検討します。TIVの導入には、このような状況を説明のうえ、患者や患者家族と医師が十分に話し合って決定することが、何よりも重要です。
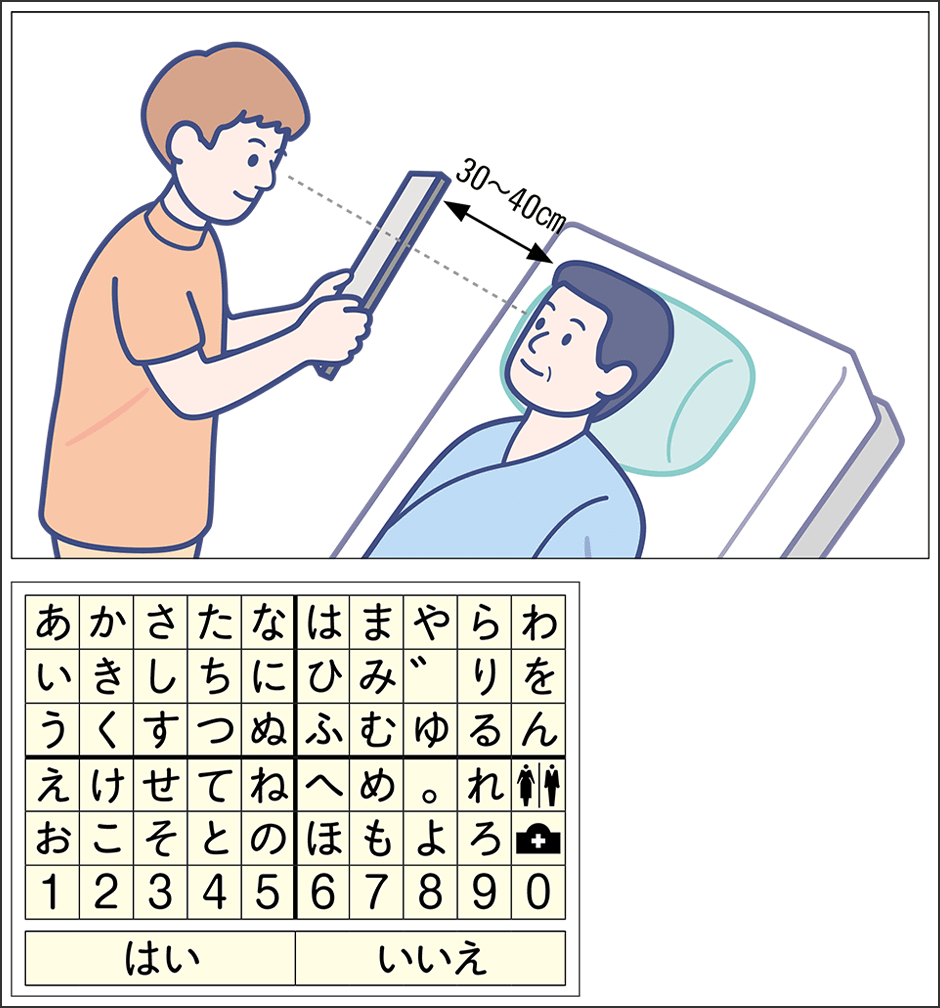
図3 ALS患者と文字盤を使ったコミュニケーション支援有効な自発呼吸がない段階では、気管切開による人工呼吸管理を行う。コミュニケーションの方法を整えることが最も大切で、眼球運動が保たれていれば、文字盤(図は一例)や視線入力装置などで意思の疎通が可能だ。
ALSのリハビリは難しく、四肢体幹に対するリハビリでは、過剰な運動の負荷は筋力低下を悪化させる可能性があり、筋肉痛・疲労感・呼吸器症状の出現や増悪がないように、注意深く行います。歩行をサポートするロボットスーツ「HAL」が有効でALSに対する保険適用がありますが、手指の障害に対するロボットリハビリはありませんでした。本学附属病院では、電気グローブ「SEM」を使用して、患者の筋力をサポートするリハビリを行っています。SEMは指先にセンサーが付いていて、物が触れるとグローブを着けた指が屈曲し、物を握る動作をします。握力がゼロに近くても、物をつかんだり載せたりする動作をわずかな時間、毎日継続したら、握力が増し、手指の使い方が上手になりました。患者自身の満足度や達成感も上がり、非常に効果のあるリハビリだと考えています。
さらに、当院では2016年から「難病専門サポートチーム」を発足させ、ALSを熟知した専門家(神経内科医、理学療法士、作業療法士、言語聴覚士、病棟・外来看護師、特定看護師、管理栄養士、難病専門の臨床心理士、ソーシャルワーカー、難病コーディネーター、看護学科教員など)が、患者の情報を共有し、生活サポートを含めた闘病生活を支援する体制を整えています。難病専門サポートチームの発足前と発足後で生存期間を比較すると、発足後のほうが生存期間が明らかに延びていることが分かりました。早期診断と多職種の専門家による治療介入の積み重ねの効果が、はっきりと示されたと考えています。
そのうえで、今後の課題は、新薬の開発はもちろんのこと、バイオマーカーの開発など早期診断の方法の確立、コミュニケーションの方法の新規開発、在宅ケアにおける介護者の負担軽減のための社会資源の充実(マンパワーの確保、介護・障害福祉の柔軟運用とサービス内容の地域差をなくす)などが挙げられます。これからも、ALS克服を目指して、日々努力を続けていきたいと考えています。