
ゲノム編集は自己の遺伝子を切ったりつなげたりする技術で、外部の遺伝子を導入する遺伝子組み換えと異なり、安全管理がしやすく、医療はじめ各分野で注目されている。2020年、アメリカで開発されたCRISPR-Cas9という技術がノーベル化学賞を受賞した。しかしこの技術はアメリカの知財で欧米が権利を押さえていて、産業利用には莫大な特許料がかかる。そんな環境下で、より精度の高い技術CRISPR-Cas3が日本で開発され、大いに期待されている。
イラストレーション/北澤平祐

ゲノム編集は自己の遺伝子を切ったりつなげたりする技術で、外部の遺伝子を導入する遺伝子組み換えと異なり、安全管理がしやすく、医療はじめ各分野で注目されている。2020年、アメリカで開発されたCRISPR-Cas9という技術がノーベル化学賞を受賞した。しかしこの技術はアメリカの知財で欧米が権利を押さえていて、産業利用には莫大な特許料がかかる。そんな環境下で、より精度の高い技術CRISPR-Cas3が日本で開発され、大いに期待されている。
「この病がこの世からなくなってほしい」
ある遺伝性難病の当事者からこのような悲痛な言葉を聞いた。親やきょうだいが次々に病にかかっていき、介護や看取りをして、自分もいつ発症するかわからない恐怖を抱えて生きている。現在は治療法がないために、最後の望みとしてゲノム編集に期待をしているという。
30億ある人のゲノムは「生命の設計図」ともいわれるが、そのゲノムを切ったりつなげたりと改変できるゲノム編集技術は、飛躍的な進歩を遂げてきた。食品、エネルギーなどさまざまな産業に応用され、なかでも特に注目されているのは医療応用だ。ゲノム編集により、これまで治すことのできなかった遺伝病が治る可能性も見えてきた。
最初にゲノム編集で開発されたのは1996年のジンクフィンガーヌクレアーゼ(ZFN)という技術で、微生物を使った「制限酵素」がDNAを切るハサミとなる。東京大学医科学研究所実験動物研究施設先進動物ゲノム研究分野の真下知士教授は、ゲノム編集の黎明期でまだ誰も注目していない時代から、この技術開発に携わってきた。
「ZFNは、その当時はあまり注目されていませんでした。分子生物学を学ぼうと農学部を選んだこともあり、私は動物の遺伝子を変えることで人の病気の遺伝子がわかるのではないかと考えていました。そこで、ゲノム編集を使ってモデル動物を作ろうと思い立ちました。その頃はZFNを使ったゲノム編集は日本では誰もやっておらず、使いにくい技術と思われて日の目を見ずに、世界的にも魚で遺伝子改変できるという報告が出ていたくらいでした。そこで2008年末から実験を始め、ラットの受精卵のゲノム編集を試みたところ、翌年すぐに遺伝子改変動物ができました。これは哺乳動物では日本初でした」
しかし、世界的にはタッチの差でアメリカから論文が出てしまった。なぜか科学的な発見は同時になされがちとはいえ、必死に研究した成果を僅差で先取りされることは悔しくなかったのだろうか。
「もちろん最初のときはめちゃくちゃ悔しかったです。最初に論文を出された方は、ZFNを開発した会社から、これを動物にも応用できないかと依頼された研究者の方だったので……。僕は自分の発想で動物に応用できないかと最初に気づいたのに、と思いました。ただし、良く言えば科学は誰が開発しても同じという部分があります。次はそれを使って新しい技術を開発していけばいいのです」
確かに、ZFNによる成功は、その後、ゲノム編集が大きく発展する礎となった。2012年にアメリカ・カリフォルニア大学バークレー校のジェニファー・ダウドナ教授と、共同研究者のエマニュエル・シャルパンティエ教授が開発したCRISPR-Cas9というゲノム編集技術は簡便で使いやすく、これによりゲノム編集の知名度と応用範囲が一気に広がった。彼女たちは2020年のノーベル化学賞を受賞している。
だが、Cas9は開発者をめぐって熾烈な特許争いが勃発し、法廷闘争が続いていた。学術的な研究目的での使用であれば問題ないが、産業利用の場合は莫大な特許料がかかる可能性が推測されている。
「例えばですが、製薬企業は特許使用料だけで100億円単位のお金がかかる可能性があるということです。これにはある疾患の創薬に関して、他の企業とは契約しないという独占的な意味合いが含まれる場合もあります。また、Cas9はアメリカの知的財産(知財)であって、欧米がその権利を押さえています。それがゲノム編集分野の日本の研究力の遅れにつながっていたため、日本政府としても日本発のゲノム編集を開発できないかという声がありました」
真下教授は京都大学から大阪大学に移籍した2015年から、当時・大阪大の竹田潤二教授が始めた新たなゲノム編集技術の開発研究に参加したという。それがCRISPR-Cas3を使ったゲノム編集だ。
CRISPRとは「Clustered Regularly Interspaced Short Palindromic Repeat(一定の間隔を空けて配置された短い回文の反復)」を略したもので、1987年に大阪大学微生物病研究所の石野良純氏(現・九州大学教授)が発見したものである。Cas(CRISPR-associated protein)とは何かといえば、このCRISPRの塩基配列の近くの遺伝子のことを指す。
「CRISPR-Casとは細菌とか古細菌などが持っている免疫システムです。細菌に感染するウイルスのゲノムを切断することで、細菌は自らを守ろうとします。それぞれの細菌によっていろいろなCRISPR-Casシステムを持っていて、Cas9が最初にゲノム編集技術として開発されました。その後、他のCasでできないのかと開発競争がありました。そのなかで、我々は世界で一番早くCas3の知的財産権をとることができました」
当初、Cas3ではゲノムをうまく切ることができなかった。しかし、CasとガイドRNAが複合体となって作用する際に、成熟型RNAではなく未熟なRNAを使ってみたらうまくいき、それが特許取得につながったという(図1)。
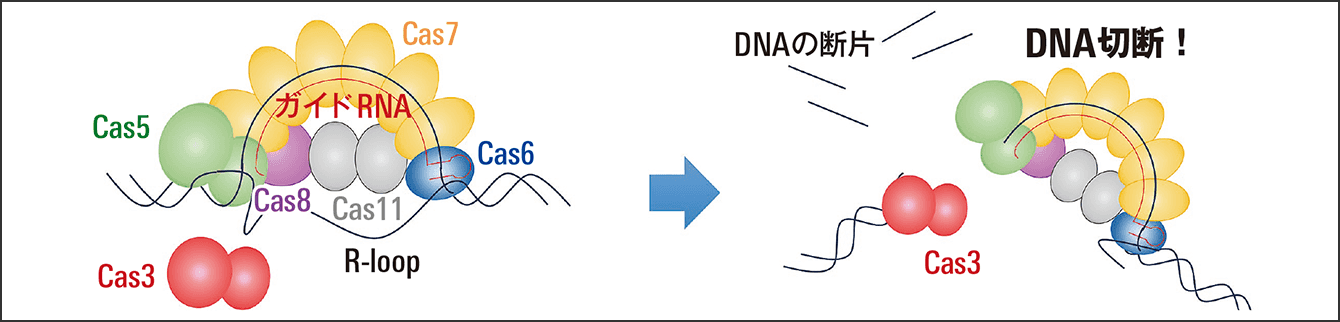
図1 CRISPR-Cas3による二本鎖DNAの切断CRISPR-Cas3によって、狙ったDNAの二本鎖を切断し、ゲノム配列の任意の場所を削除、置換、挿入できる。
海外ではCas12、13、14が開発され、知財化されている。しかし、それはCas9と同じ研究チームによる成果であり、Cas12とCas13についても権利争いが続いている。特許の争いがなく、日本発の技術ということでCas3に期待が集まっている。
それではCas9とCas3の違いは何だろうか。真下教授はこのように話す。
「Cas9がハサミであるのに対してCas3はシュレッダーにたとえられます。切る効率からすると、Cas9のほうが、ピンポイントの配列を鋭く切ることが可能です。一方で、Cas3は遺伝子を丸ごと潰したいときに、大きく切ることができます」
遺伝子はアデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4つからできている。ゲノムの塩基を文字にたとえると、30億文字の設計図がこのたった4文字でバラバラに書かれているともいえる。
「例えば、もともとATGC配列だったところのAが抜けてGに替わってしまう病気があったとします。Cas9はピンポイントで切るのですが、Cas3はシュレッダーのようにどんどん切っていくことで、この領域を全部丸ごと破壊できて、最もパワフルだという特徴があります」
ゲノム編集は約2万個ある遺伝子を切断したり、改めてつなげたり、他の配列を入れる作業だ。ゆえにその正確性は重要となってくるという。
「細胞や受精卵は、一度遺伝子が切れてもまたくっつくものです。人の細胞は紫外線などで遺伝子が傷ついても修復できますよね。だから、ゲノム編集は切る、治そうとする、切る、治そうとすることのせめぎ合いで、最後に遺伝子が破壊される、あるいは書き換えられるということになります」
さらに狙った遺伝子ではなく間違った遺伝子を切ってしまうことも理論上では起こりうるという。これはゲノム編集の安全性に関わってくる。
「ゲノム編集の安全性でまずいわれるのはオフターゲットの問題です。2万個の遺伝子のうちたった1個の遺伝子を狙うのはオンターゲットといいます。間違って別の遺伝子を切ってしまわないかという懸念です」
安全性を高めるには認識できる文字、つまり塩基の数が重要だという。
「遺伝子組み換えによく使われる制限酵素は、ゲノム上の例えば4文字だけを特異的に認識して、そこだけを切ってくれるツールでした。この同じ4文字の配列が他のところに出てくる確率は4の4乗分の1となり、30億文字のなかには膨大にあります。そうであれば、他の遺伝子を切ってしまうのでめちゃくちゃ危険です。一方、狙った遺伝子しか切らないといえるのは、4の16乗を越えてきたあたりです。4の17乗になるとゲノム上にここにしかない、ここしか切らないといえます」
この「間違って別の遺伝子を切るかもしれない」という問題が、ゲノム編集の安全性では最も懸念されることだ。
「4の4乗だとドカッと切ってしまいますが、4の17乗であれば正確に切れる。とすれば、CRISPR-Cas9は20文字を認識するので、正確に一致します。ただし、理論上は1個の遺伝子しか切らないはずですが、少しずれて文字を切ることも、可能性は少ないのですが考えられることです。それが例えばがんの遺伝子を傷つけたりすると、治してもがんがどんどん増えてしまうことになります。このように目的遺伝子とは異なる変異が入ることをオフターゲット変異と呼びます」
その点で、Cas3はCas9よりも読める文字が多いという利点があると真下教授は話す。
「Cas3は27文字を読むことができます。つまり4の27乗と、より安全性が高いのではないかと考えています。他にも、身体の中にCasのような違うタンパク質が入ればどうしても身体は免疫反応を起こしますので、そういう影響も注意しなければならない。一方で、そこに治療法を待っている患者さんがいます。くすりを逆から読むとリスクであり、どうしても必ずリスクが出るものですが、安全性を確認しつつ必要な人に届けていきたいと思っています」
真下教授が取締役となっている大阪大のバイオベンチャーC4Uは、Cas3の産業活用や医療応用を担う会社だ。Cas3を細胞に入れるときの入れ方など、Cas9に比べてまだ改良すべき問題はたくさんあるというが、徐々に使用する企業や研究施設が広がってきている。
では、現在どのような疾患への医療応用を研究しているのだろうか。
「まずゲノム編集で効果が出やすいのは、1つの遺伝子を治すことが治療につながる単一遺伝子疾患です。他に治療法がなかったり、重い症状が出てしまったりするために、安全性とリスクを考えた上で遺伝子治療が有効かの判断がしやすい」
2021年、C4Uは国立成育医療研究センターと共同で、Cas3によるゲノム編集を使った治療法について、遺伝性疾患であるライソゾーム病の一種を対象に研究を始めると発表した。
「この病気は肝臓にいらないタンパク質がたまって除去できなくなる病気で、酵素補充療法はあるものの頻繁に通院しなければならないものです。ゲノム編集で原因遺伝子を治療することによって、病気を完治させたいと願っています」
さらに2022年1月、真下教授とC4Uとトランスジェニックというバイオベンチャーは共同で、Cas3の有用性について、家族性アミロイドポリニューロパチーに関与するトランスサイレチン(TTR)エクソンヒト化マウスを用いて評価し、将来の遺伝性疾患に対する新規の遺伝子治療につなげることを発表した。
もう一つ、真下教授の研究として期待したいのは、がんの治療だ。
「がんの治療で現在最も有望とされているのは、本庶佑先生(京都大学特別教授)のがん免疫療法と、そしてCAR-T療法だと思っています。CAR-T療法にゲノム編集技術を使うことでより良い治療法を目指したい」
CAR-T療法とは、がん患者の末梢血由来T細胞を体外に取り出し、がんを認識する遺伝子CARを導入することで増殖させ、がん細胞を攻撃できるようにしてから患者の血液に再び戻す治療法である。これは極めて有効な治療法と注目され、がん治療のブレークスルーだと注目されている。これはすでに血液がんでは臨床応用されている。また、がんの90%は固形がんであるため、血液がんだけでなく、固形がんにも効くような次世代型CAR-T細胞の開発も行われている。
「山口大学の玉田耕治教授らは、最近、固形がんにも効果があるプライムCAR-T細胞を開発されました。CAR-T細胞が、がんの治療効果が高いことはわかっていますが、一方で1人当たり5000万円もの治療費がかかっていました。これまで1人の患者さんから免疫細胞であるT細胞を取ってきて、無菌の状態でCARという遺伝子を入れて戻す自家移植で行っており、この作業に手間とお金がかかっていました。ただこれを他家移植といって、健常者の細胞で行うことができれば、もっと安価にできます。ただし、他人の血液を体内に入れると拒絶反応が出るという問題がありますが、ゲノム編集により拒絶しないような遺伝子にすることで、その問題がクリアできると考えています」
そしてゲノム編集は診断キットにも応用されている。真下教授はCRISPR-Cas3を使って新型コロナウイルス感染症迅速診断キット「CONAN」法を開発した。これはPCR検査よりも迅速で、抗原検査よりも感度が高いものだという。
「CONANはPCRの延長線上にあり、ウイルスを増やして、Cas3で新型コロナウイルスに特異的にくっついてくれる試験紙です。また抗原検査のようにその場で診断できる。アメリカではCas12と13を使った診断薬はすでに売り出されていますが、残念ながら日本ではまだです」
遅れている理由の一つに、Cas3のタンパク質を大量に作らないといけないという問題があるが、診断薬においても期待が大きくなっている。これからのゲノム編集のあり方について、真下教授はこう言う。
「僕は基礎研究者ですし、動物遺伝学を専門にやってきた人間で、遺伝子治療は専門ではありませんでした。だからCas3を開発したときはみんなに使ってほしいという思いでC4Uを起業した。この社名はCRISPR for Youという意味です。
しかしCas9が先行して実際に患者さんを治せることがわかってくると、やはり技術を開発しただけでは責任がとれない、必要な人に届けないといけないと考え直しました。まだ研究しないといけない課題はたくさんありますが、治療法を待っている人に届けられるようにしたいと思っています」