筋ジストロフィーは遺伝子変異疾患の中でも重症化しやすい難病だ。遺伝子変異によってジストロフィンというタンパク質の合成ができなくなり、動くほど筋組織が破壊されて萎縮が進行する。決め手が少ない中、現在期待されているのが、ゲノム編集で原因遺伝子を切除し、正常なタンパク質合成を取り戻す治療と、iPS細胞を使った細胞移植治療の組み合わせだ。
特集 ゲノム編集入門 遺伝子編集とiPS細胞治療で「筋ジストロフィー」に光明
構成/河﨑貴一
国の指定難病は約330種類ありますが、その半分ほどは遺伝子変異が原因か、あるいは遺伝子変異が関連していることが知られています。遺伝子変異によって起きる病気の治療は難しく、先天的に病気が起きるので、小児の患者さんもいます。
遺伝子変異疾患の中でも重症な病気の一つに、筋ジストロフィーがあります。この病気には筋強直性やベッカー型などいろいろな種類がありますが、それらの中でも、もっとも重症で患者数の多いのがデュシェンヌ型です。筋ジストロフィーの小児の患者さんは、日本では2500~4500人程度と推定されています。原因遺伝子の変異が性染色体のX染色体上にあるので、患者さんの大部分は男の子です。
動けば動くほど筋組織が壊れてしまう
哺乳類の多くは、雄(XY)と雌(XX)の性染色体を持っています。雌(XX)だとジストロフィン遺伝子が2コピーあるために、1コピーが変異で壊れてしまっても、もう一つの遺伝子から正常なジストロフィンタンパク質を合成することができるので、男の子に筋ジストロフィーの患者さんが多いのです。
健常な人なら、筋肉を動かせば動かすほど、筋トレ効果で筋肉は強く、太くなります。ところが、筋ジストロフィーの患者さんの筋肉では、筋肉の膜裏側で働いているジストロフィンというタンパク質がないために、動けば動くほど筋組織が壊れてしまいます。患者さんが動いたり、歩いたりするようになると、そこから筋組織の破壊、萎縮がどんどん進んでいきます。10代になると、自分で歩いたり、立ち上がったりができなくなって車椅子の生活になり、20代になるとほぼ寝たきりになってしまいます。
デュシェンヌ型筋ジストロフィーは、フランス人神経学者のギヨーム・B・A・デュシェンヌが、1860年代に症例を報告したことから、病名が付けられました。その後、分子生物学が進歩して、病気の原因がジストロフィンという遺伝子であることを見つけたのは、アメリカ・ボストン小児病院のルイス・M・クンケル医師で、1986年のことでした。
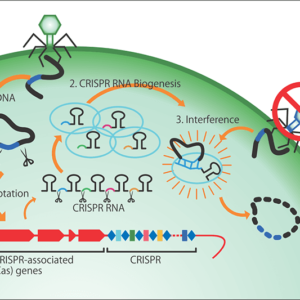
地球上に知られている生物はすべて、DNA(デオキシリボ核酸)やRNA(リボ核酸)という核酸を持っています。その生物を形作る設計図が、すべてそこに収納されています。核酸は、アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4種類の塩基が3個で1組になって、タンパク質を合成するためのアミノ酸の指定や、「ここからタンパク質をつくりなさい」とか、「タンパク質をつくるのを止めなさい」という命令を行います。
ジストロフィン遺伝子自体は、全部で220万文字(塩基)ぐらいの巨大な遺伝子です。ところが、このうち数塩基が壊れるだけで、ジストロフィンというタンパク質が合成できなくなってしまいます。例えば、ジストロフィンをつくる遺伝子の一部が変異して、「AAA」が「TAA」という塩基配列になると、「その部分でタンパク質の合成を止めなさい」という命令になってしまい、ジストロフィンが合成できなくなってしまうのです。そこで、上記の「合成を止めなさい」という命令文をゲノム編集で削り取れば、最後まできちんとタンパク質を合成できるようになります。これが遺伝子編集の仕組みです。
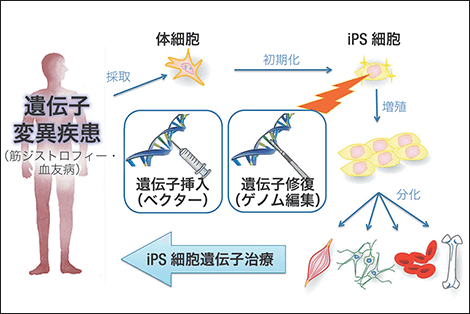
図1 iPS細胞を利用した新しい遺伝子治療戦略iPS細胞を利用し、より安全なヒトiPS細胞の作製・選別・方法の開発を目指し、血友病などの先天性疾患を遺伝子治療する新しい医療の実現に取り組んでいる。
治療効果が長期に維持される
なぜ、遺伝子編集による治療について研究するようになったのか。それは、私自身が小さい時から病弱だったことと関係があります。私は小学校時代から小児ぜんそくがあって、学校も休みがちでした。発作が起きると、息ができなくなってとても苦しい思いをしたものですが、ステロイドなどの薬を飲むと、嘘のようにスーッと症状が引いて息ができるようになりました。薬の力はすごいなと思う一方で、薬が体外に排泄されたりすると、効かなくなってしまいます。それで、薬の力に興味を持つようになりました。
薬に興味はあっても、医学部に行きたいという思いは強くはありませんでした。目の前の患者さんを助ける医学は尊い学問だとは思いますが、私としては研究成果で広く世の中の役に立ちたい。それに、私は血を見るのがあまり好きではありません。いまも、動物実験は苦手です(笑)。
薬は化合物でできているので、名古屋大学工学部の化学系に進みました。そのうち、生物系の遺伝子工学に触れる機会があって、遺伝子を編集できるようになれば生物のいろいろな性質をコントロールできるようになる、遺伝子変異疾患の患者さんの場合には、遺伝子の変異を治すと生涯治ったままの状態を維持できるようになる、と考えるようになりました。それが遺伝子工学の研究を始めた理由です。
学位を取るまでは、ニワトリの卵に遺伝子を組み込む研究をしていましたが、ES細胞(胚性幹細胞)を使う研究をしたいと思うようになり、カナダのトロント小児病院に留学を決めました。トロント小児病院は、北米最大の小児専門病院で、デパートのように、病気で苦しんでいる子どもたちが楽しめる仕組みがいたるところにありました。筋ジストロフィーをはじめ遺伝子変異疾患の子どもたちもたくさん入院していました。私は、鎌状赤血球貧血や血友病の患者さんの遺伝子治療をするために、治療用遺伝子をのせて運ぶ、ウイルスベクターの開発を行っていました。
カナダで研究を続けていた2006年、山中伸弥先生のiPS細胞(人工多能性幹細胞)に関する論文を知りました。最初は、「ほんまかいな」と信じられませんでしたが、自分でも試してみると、論文どおりにiPS細胞がすぐにできました。「これはすごいことだ」と驚き、それからiPS細胞の研究にのめり込んでいきました。
ゲノム編集なら治せる可能性がある
私が京都大学iPS細胞研究所(CiRA)に入ったのは2010年です。山中先生に認めていただいて、iPS細胞研究所で研究者として働くための辞令を受け取る時、山中先生から、「このCiRAで、iPS細胞を使ってゲノム(遺伝情報の全体)の1塩基を書き換えできるような技術開発を進めてほしい」と言われました。iPS細胞を活用するうえで、ゲノム編集技術が必要になってくると私も認識していたので、それからゲノム編集技術の研究にシフトしていきました。

(左)山中伸弥教授。iPS細胞研究所の前にて。(写真提供:京都大学iPS細胞研究所)
(右)ヒトiPS細胞。線維芽細胞から樹立したヒトiPS細胞のコロニー(集合体)。コロニーの横幅は実寸約0.5㎜。(写真提供:京都大学 山中伸弥教授)
私がiPS細胞研究所でゲノム編集治療の研究対象としてディシェンヌ型筋ジストロフィーを選んだのには2つの理由があります。
1つ目の理由は、前述のように、ディシェンヌ型筋ジストロフィーは、筋ジストロフィーの中でもっとも重症で、小児の遺伝子変異が原因の病気ではもっとも患者数が多いからです。従来の遺伝子治療では、遺伝子補充療法といって、壊れて動かない遺伝子の代わりに、正しく働く遺伝子をまるごと外から細胞内に入れる治療法が主流です。ところが筋ジストロフィーは、原因のジストロフィン遺伝子がヒトのゲノムの中ではトップ3に入るぐらい巨大なので、それまでの遺伝子補充療法では治療は困難です。一方、遺伝子変異を直接修復できるゲノム編集なら、ディシェンヌ型筋ジストロフィーを治せる可能性があると考えました。
2つ目の理由は、iPS細胞研究所で一緒に着任した、櫻井英俊先生(准教授)とお会いできたことです。櫻井先生は、iPS細胞から骨格筋へ分化誘導し、それを使って筋ジストロフィーをはじめとする疾患の病態再現や治療薬探索などの研究をされています。日頃から、いろいろなことをお話しする機会があり、筋ジストロフィーについても学ばせていただく中で、この疾患にはゲノム編集が使えるのではないかと思い立ちました。
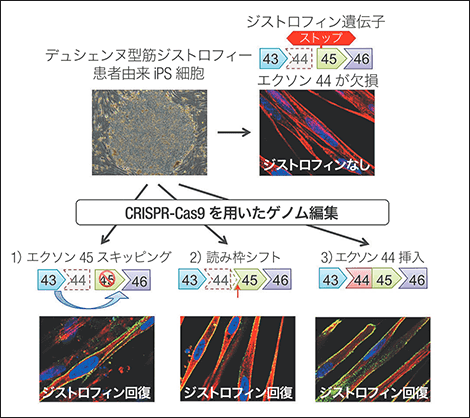
図2 デュシェンヌ型筋ジストロフィーの遺伝子変異修復法デュシェンヌ型筋ジストロフィーのエクソン44を、CRISPR-Cas9を使って3種類の方法で遺伝子編集を行い、いずれも成功した。
当時は、体の中に遺伝子配列を届けるためには、ZFN(ジンク・フィンガー・ヌクレアーゼ)という酵素を使う技術しかなく、一つつくるのに約300万円もかかっていました。それが2012年になると、CRISPR-Cas9(クリスパー・キャス・ナイン)という酵素を使う技術が開発されて、研究用の試薬は数万円のレベルにまで価格が下がって手軽に使えるようになりました。遺伝子編集のためには、遺伝子のどこを切るかという指定をするために短いRNAを設定するのですが、それも研究室では数千円レベルでつくれます。
CRISPR-Cas9を用いた遺伝子編集は、例えば百科事典のような大きな遺伝子の文字列から標的とする所だけをしらみ潰しに探し出して、切り取って修復するような作業です。巨大な遺伝子の中から標的となる部分をCRISPR-Cas9が見つけ出して切断するまでにかかる時間は数時間以内です。そのあと、遺伝子を修復するのは細胞自身ですが、その時間も数分とか数十分以内です。私たちの体のゲノムは、紫外線や放射線によって切断される場合がありますが、そのまま放っておくと細胞死やがん化の危険があるので、細胞に自己修復する機構が備わっているのです。
私たちは以前、遺伝子のうち、ジストロフィン遺伝子の44番目のエクソン(タンパク質合成の情報部分)が欠損することによって、ジストロフィンタンパク質の読み枠がずれているデュシェンヌ型筋ジストロフィーの患者さんからiPS細胞を作製しました。遺伝子の修復には3つの戦略を立てました。
1)45番目のエクソンを読ませなくして43番目と46番目のエクソンを直結させて、読み枠を戻す。
2)塩基を1つ挿入して読み枠を戻す。
3)44番目のエクソンを元の位置に挿入する。
これらの方法で修復させたiPS細胞を骨格筋細胞へ分化させたところ、いずれの修復方法でもジストロフィンタンパク質がつくられていることが確認できました。
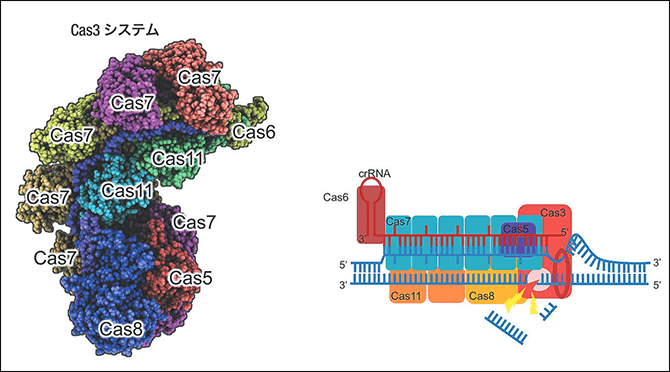
図3 新ゲノム編集ツールCRISPR-Cas3CRISPR-Cas9などのゲノム編集ツールは、誘導可能な切断長が短く、知的財産権の問題があったので、堀田講師らは新しいゲノム編集ツールを開発した。
ウイルスを使うよりも安全性が高い
最近では、CRISPR-Cas9を患者さんの筋組織に送り届けるナノカプセルの研究をしています。もし、ベクター(運び屋)としてウイルスを使うと、ウイルス自身が細胞内にとどまって、発現がダラダラと続いてしまいます。細胞内でずっと働いていると、切断すべき所以外の遺伝子も切ってしまうリスクが高まります。その点、CRISPR-Cas9の酵素をウイルス以外の方法で筋組織に送り届けることができれば、ウイルスを使うよりも安全性がはるかに高いのです。患者さんの体内の細胞でゲノム変異を修復するこの方法は、患者さんの筋肉組織がそれ以上に壊れるのを予防し、リハビリ等をすれば、治った筋肉を維持活用できることが期待されます。
一方、筋ジストロフィーがかなり進行して後期になると、筋繊維が壊れて、線維組織や脂肪組織に置き換わってしまっているので、ゲノム遺伝子を治しても筋肉は戻りません。そこで、iPS細胞から骨格筋や骨格筋のもとになる幹細胞をつくり出して移植すれば、新しく筋繊維がつくられる可能性があります。この治療法は、櫻井先生が研究されています。
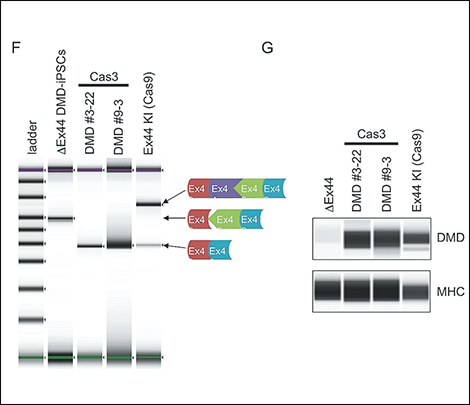
図4 CRISPR-Cas3によるエクソンスキッピング治療CRISPR-Cas3の切断パターンを解析すると、標的配列の上流に欠失が導入され、変異部位を削除することで、ジストロフィンタンパク質の回復に成功した。
要するに、筋繊維の細胞が壊れる前であれば、私たちの遺伝子編集治療が有効で、筋繊維が壊れたあとは、後者の細胞移植治療が大事になってくると思います。どちらも大切な治療法で、両方の医療技術を研究していく必要があります。
ゲノム編集は、新しい技術なので、安全性、有効性に関しては非常に慎重にテストしていかなければなりません。
遺伝子編集技術が確立すれば、他の遺伝子疾患にも応用できるはずです。私たちは患者さんたちの切実な思いを受け止めて、一生懸命研究を続けています。