
受精卵が細胞分裂を繰り返し、各器官に分化して体は形成される。生命の根源ともいえるこの仕組みには、遺伝子の活性化・不活性化を制御するエピジェネティクスと呼ばれる制御機構が関わる。その「取扱説明書」ともいえるエピゲノムはゲノムを化学修飾したもので、卵子と精子に存在し受精後に初期化される。ところが、一部に初期化されない領域があり、その情報は組織に伝わる。一方、化学修飾は化学反応であるため、エピゲノムは環境の影響を受けるという。
イラストレーション/北澤平祐、千野六久(図版)

受精卵が細胞分裂を繰り返し、各器官に分化して体は形成される。生命の根源ともいえるこの仕組みには、遺伝子の活性化・不活性化を制御するエピジェネティクスと呼ばれる制御機構が関わる。その「取扱説明書」ともいえるエピゲノムはゲノムを化学修飾したもので、卵子と精子に存在し受精後に初期化される。ところが、一部に初期化されない領域があり、その情報は組織に伝わる。一方、化学修飾は化学反応であるため、エピゲノムは環境の影響を受けるという。
人間の「すべての始まり」は受精卵だ。卵子と精子が受精し、最初は1つの小さな細胞であったものが2つ、4つ……と分化していく。その繰り返しの先に胎児が形作られ、1人の人間が誕生していく。そのプロセスは、まさにこの世の神秘の一つといえるだろう。
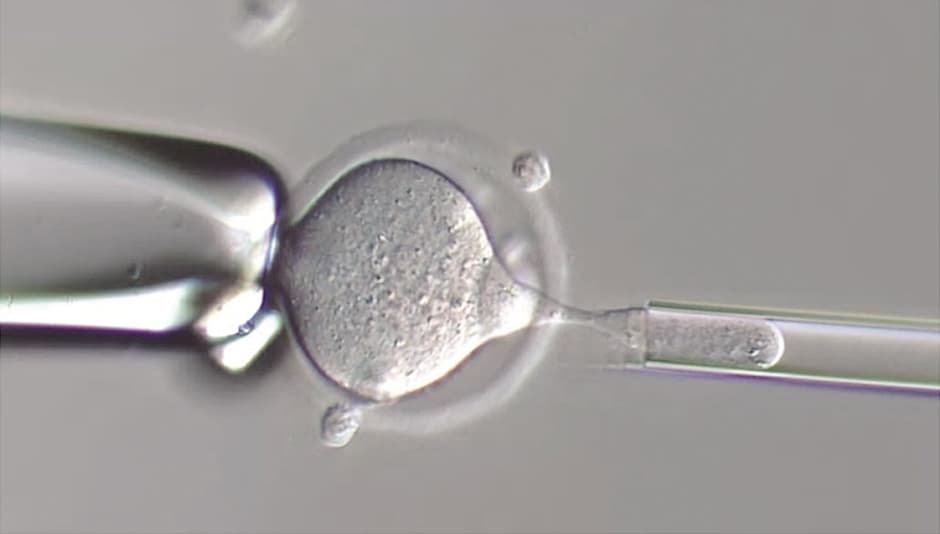
顕微鏡で見たマウスの卵子マウスの卵子のゲノムを除いているところ。
理化学研究所生命医科学研究センター・疾患エピゲノム遺伝研究チームリーダーを務める井上梓さんは、そうした受精卵の最初の姿は「本当に不思議で魅力的です」と語る。
「やっぱり不思議なんですよ。どうして1つの細胞が分化を繰り返して、ヒトになってゆくのか。そのとき、卵子の中では何が起こっているんだろう、と思います。いわば私のしている研究は、その受精卵の中で起こっているすべての現象を、“分子の言葉”で説明すること。卵子や受精卵というブラックボックスが、どういう仕組みでできているのかを知りたいんです」
井上さんの研究チームのテーマは「哺乳類の卵子を介したエピゲノム遺伝機構」を解き明かそうというものだ。その内容を説明するためにはまず、「受精卵」とはそもそもどのようなものかをおさらいしておく必要があるだろう。
親の持つ形質は、DNAを介して子へと伝えられる。そして、DNAに刻まれた情報を伝達するのが、卵子と精子という配偶子である。
「エピゲノム」は、この配偶子のDNAを読み込むための取扱説明書のようなものだ。井上さんはゲノムを本に例え、エピゲノムとはゲノムのどこを読むべきかを指示する付箋のようなものだと言う。
「もともとは1つの細胞である受精卵からヒトが形作られるとき、ゲノムだけでは細胞が異なる性質を発揮することはできません。よって、細胞が異なる性質を発揮できるように、ゲノムの中のどの遺伝子を活性化・不活性化させるか、というプログラムがあるわけです。そのような、ゲノムに対する制御機構である化学修飾をエピジェネティクスと呼ぶわけです」(図1)。
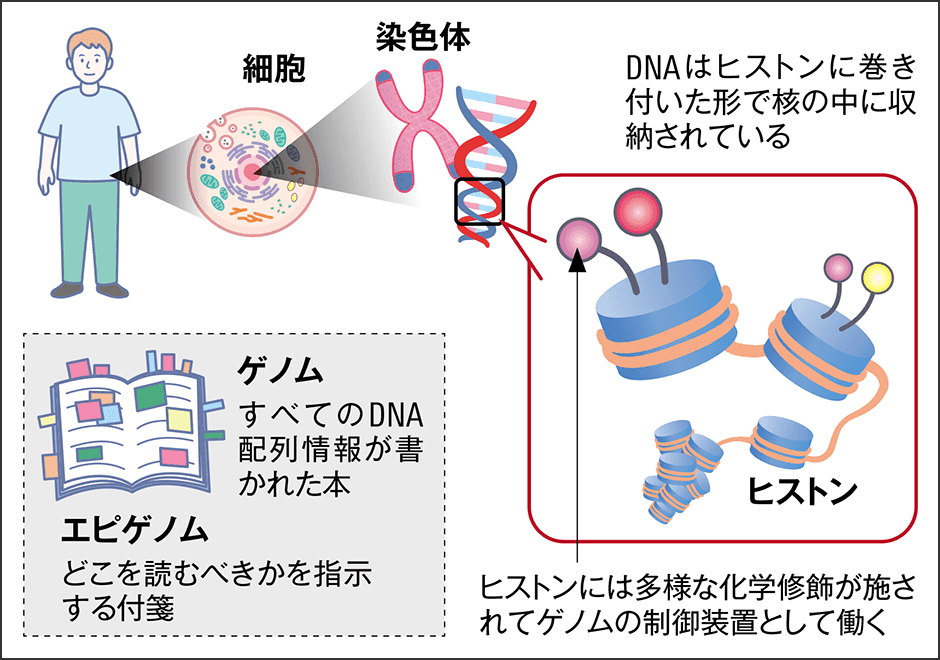
図1 エピジェネティクスとは多様な化学修飾を施されたヒストンがゲノムを制御している。その制御機構をエピジェネティクスと呼んでいる。
「化学修飾」とは、タンパク質やDNAといった生体内の分子の中から、特定の「官能基」(有機化合物の中にある特定の構造を持つ基)を化学的に変化させることを指す。そのような変化が起こると、DNAはある一部の領域が活性化したり、不活性化したりする。言葉を換えれば、「ゲノムの制御機能」ということである。
細胞内のDNAは「裸の状態」でいるわけではなく、ヒストンという塩基性の小さなタンパク質に巻き付き、核の中に収められている。細胞はこのヒストンを有効活用しており、ヒストンに化学修飾を付け加えることで遺伝子の発現を制御している。そのような化学修飾にはメチル基(CH3)を分子に導入するメチル化、アセチル基(COCH3)を導入するアセチル化といった種類があり、それらによって「この領域はメチル化修飾、この領域はアセチル化修飾といった組み合わせができ、それぞれの領域で遺伝子がオンになったりオフになったりする」(井上さん)わけだ。こうした制御機能によって、同じDNAを持つ細胞が、異なる遺伝子を発現することができるのである。
そして、井上さんの研究チームが研究しているのは、受精後にDNAと一緒に伝達されるエピゲノムが、それぞれの配偶子が作られる過程でどのように形作られ、次世代へと伝わるプロセスにおいてどんな働きをしているのか、ということだ。
「卵子には卵子のエピゲノムがあり、精子にも同じように化学修飾のパターンがあります。その2つが受精すると、お互いのゲノムが受精卵の中に運ばれるわけですが、そのときにエピゲノムの化学修飾も一緒に運ばれるんですね(図2)。しかし、まったく異なる形成過程を経てできている卵子と精子では、エピゲノムのパターンも異なっています。それが受精卵という細胞の中で1つになるので、当然のことながら細胞内では衝突が起こる。このアンバランスを解除しなければ、次世代の発生はうまくいきません」
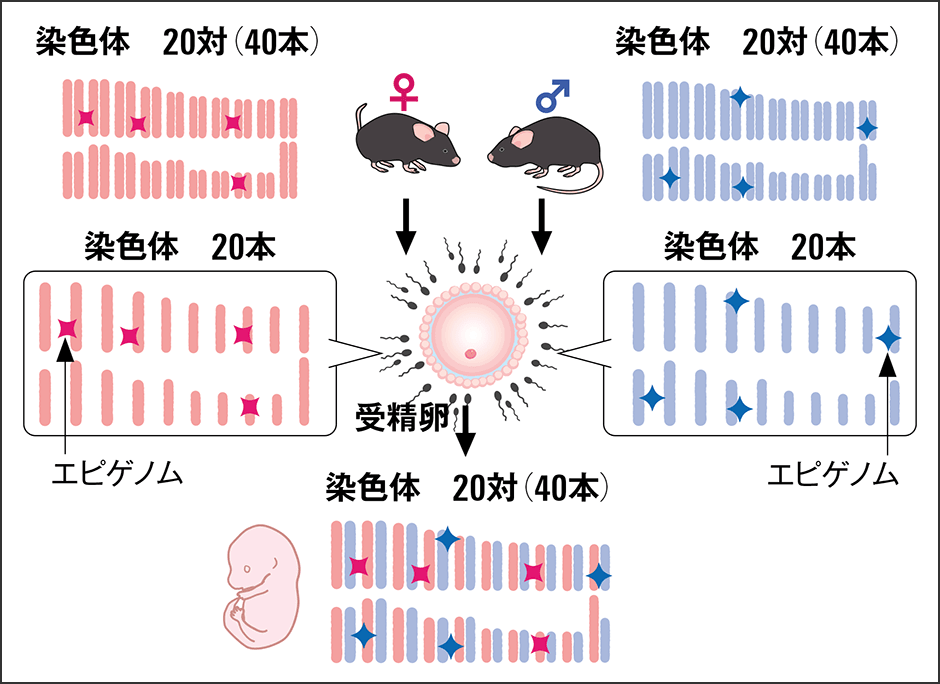
図2 ゲノムと一緒にエピゲノムの一部も次世代に伝わる卵子と精子はそれぞれ違うエピゲノムを持っているが、受精したときにゲノムと一緒にエピゲノムの化学修飾も運ばれ、細胞の中で1つになる。
受精後、卵子と精子のDNAが1つになる——それが次世代の誕生につながるためには、受精卵の中で井上さんの言う「パターンの異なるエピゲノムのアンバランス」の初期化(リプログラミング)が行われる必要がある。
これまでの研究では、配偶子が核内のエピゲノム情報を胚に持ち込むのかどうかは、よく分かっていなかったという。とりわけ卵子は数の少ない細胞であるため、エピゲノムを調べること自体が極めて困難だった。だが、近年のゲノム解析技術の発達により、生殖細胞や初期胚のエピゲノムが調べられるようになった。
「受精卵や卵子は生体から取れる数が少ないので、そのヒストン修飾を解析するには技術革新が必要でした。そして、その技術が出てきた2016年ごろ、私はハーバードメディカルスクールに留学していて、ちょうどそのような技術を開発するラボにいたんです。私がずっと続けていた受精卵や卵子を扱う生殖工学と、最先端のエピゲノム解析技術がタイミングよく合致したんですね」
そうした中、井上さんの研究チームは、卵子由来のエピゲノムがどのように初期化されていくかを調べ始めたのだが、興味深いのはその一方でエピゲノム情報には「初期化されない領域」もあることが分かってきたことだ。
「精子由来のエピゲノム、卵子由来のエピゲノムがどうやって初期化されるか。私たちが研究しているそのメインテーマには、さらに先のストーリーがあったんです。確かに、卵子と精子のエピゲノム情報の大部分は、受精後に初期化されます。ところが、調べていくと一部に初期化されない領域があり、そのエピゲノム情報が胎児の胎盤の組織に伝わっていくことが分かってきたんです」
配偶子のエピゲノム情報のすべてが初期化されるわけではなく、一部が受精後も残されていく——。
この発見が大きな意味を持つのは、配偶子のエピゲノム情報と「環境」との間に何らかの関係があるという「仮説」が、そこから導き出されるからだという。
「我々がいろんな環境に曝露されても、ゲノム自体が大きく変わることはありません。しかし、エピゲノムは化学修飾——つまりは化学反応であるため、環境の影響を受けるわけです」
「すると、ここで1つの問いが生じます」と井上さんは続ける。
「親世代のエピゲノム情報が次世代の胎児に受け継がれるのだとすれば、親世代が置かれてきた環境が、その人の卵子や精子のエピゲノム情報に影響を与えることがあるのではないか(図3)。そして、環境がエピゲノム情報に影響を与えるのであれば、胎児の発生、胎盤の機能にも影響を与える可能性があるのではないか。今、私たちはその点を研究しています」
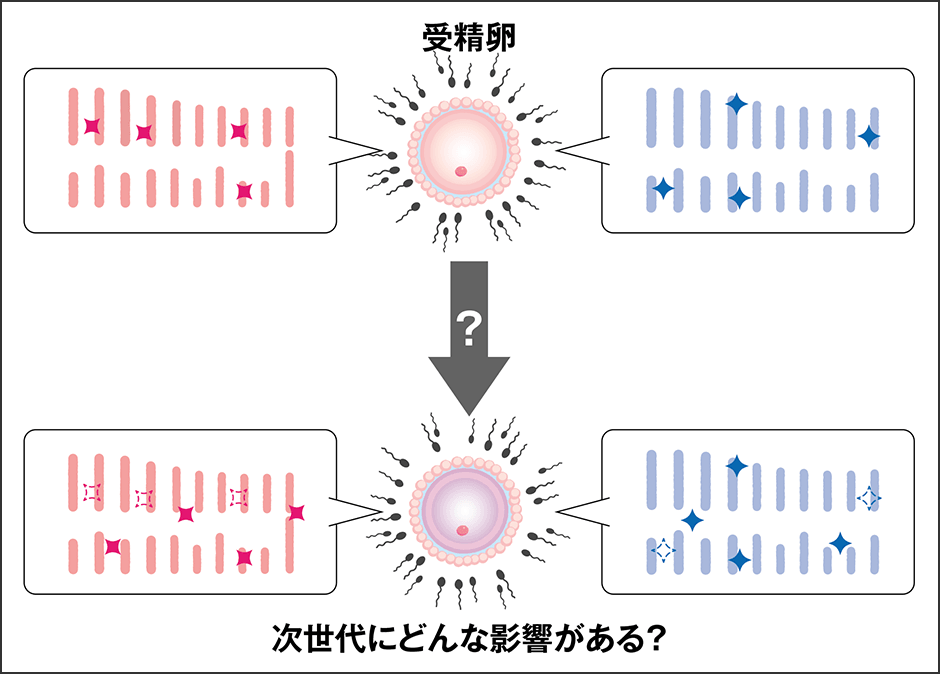
図3 卵子や精子のエピゲノムは環境によって変わる?ゲノム自体は環境によって大きく変わることはないが、エピゲノムは化学修飾(化学反応)である。ゲノム情報が次世代に受け継がれるとすれば、親世代の置かれた環境が配偶子のエピゲノム情報に影響を与える可能性も考えられる。
例えば、科学誌Natureに発表された研究に、抗生物質を使って腸内細菌をなくした雄のマウスを作ると、その精子に由来する仔の遺伝子発現に異常が起こりやすくなった、というものがあるという。
「この研究は大きな議論を巻き起こしています。環境の一つとして、腸内環境が精子のエピゲノム情報の変化に関わっている可能性が示されているからです。腸内環境が変われば、体内でさまざまな代謝物やバランスも変化します。その中で、エピゲノムという化学修飾が影響を受ける可能性は当然あり得ると思います」
疫学研究では飢餓状態にあった母親から生まれてきた子どもが、長期的に糖尿病などになりやすくなる、といったデータもある。しかし、それは井上さんに言わせれば、「妊娠期の胎内の環境が変われば胎児自体が直接影響を受けているわけですから、生まれてきてから何らかの変化があっても不思議ではない」。母親が妊娠する以前の体内環境が、世代をまたいで胎児に影響を及ぼす可能性の研究とは、根本的に問題意識が異なる。
「ヒトの卵子は胎児の頃から卵原細胞としてあり、思春期の前後から卵巣の中でその細胞が成長していきます。そして、大きくなって排卵されると、受精することが可能になりますよね。排卵されるたびに次の卵子が発育されるプロセスを、ヒトは思春期前後から閉経に至るまで繰り返していくことになります。エピゲノム情報が環境に影響を受けるのであれば、その間に何が起こっているのか。それはいまだ誰も知らない。私たちの研究は、そのことを明らかにしていくものであるわけです」
さて、そのように語る井上さんは、「研究」というものにどのような思いを抱いているのだろうか。
「私の関心は医療に対するものではありません。子どもの頃から生き物そのものが好きだったんです」
井上さんはそう語る。生き物を好きになったのは、高校で生物を教えていた父親の影響があるという。家で生き物のことについて触れる機会が多く、当時から生物学者になりたいと思っていたそうだ。
現在のような研究の道に進もうと考えたのは、大学院に進む際のことだったと井上さんは振り返る。
「自分の道を探すときに、研究対象を選ぶことには2つの考え方があると私は思っていました。一つは『人の役に立つ研究』を行うこと、もう一つはブラックボックスに魅せられ、『何も分かっていないからこそ、その研究をしたい』と考えること。私は明らかに後者のタイプで、そのときに頭に浮かんだのが受精卵の研究だったんです」
井上さんが受精卵という研究対象に魅了されたのは、その頃に登場した細胞の初期化という概念に惹きつけられたからだったという。
「2000年前後にクローンマウスが誕生しましたよね。分化を終えた細胞でも、卵子に移植されれば、再び個体になることができる。しかし、そういう現象自体は分かっていても、そのメカニズムは何一つ分からなかったわけです。なぜなら、1つの小さな細胞の中身を解き明かすような技術が、当時はまだ存在しなかったためです。よって、できることは少なかったけれど、とにかく不思議で仕方がない、知りたい。そんな思いでこの分野に進みました」
その後、iPS細胞の登場によって、卵子を使わなくても培養細胞で細胞の初期化の研究が行えるようになった。だが、井上さんの興味はあくまでも「受精の際のリプログラミング」。前述のように、卵子と精子のエピゲノム情報がなぜ消えるのかを解き明かしたかった。
「iPS細胞を研究している人たちの傍らで、私は細々と『卵子で何が起こっているか』という研究を続けていました。長く研究を続けていると、『クエスチョン』がたまっていくわけです。そのクエスチョンを解くための技術が出てきたことで、エピゲノムの次世代への伝達というテーマが浮かび上がってきたんですね」
井上さんは次世代にエピゲノム情報が伝達されるという発見について、「環境とエピゲノム情報の関係性を考えるうえで、新しい仮説を立てられるようになったことが大きい」と語る。
「親から次世代に長期的な影響を及ぼし得る卵子内の『分子』を同定できた。これによって、これまではとっかかりがなく漠然としていた問題を、検証可能な科学的問題として研究することが成り立つようになったわけです」
井上さんの研究は、生命の根源とは何かを問うものでもあるだろう。エピゲノム情報と環境の関係性は、そう簡単に解き明かされるものではない。だが、そのように「謎」に包まれている分野であるからこそ、井上さんの研究に対するモチベーションは高まっていく。
「今後、まだまだ20年以上は続けていく研究です。受精卵はすべての始まり。エピゲノム的に言えば、『すべてがプライム(初期)状態』にあるのが受精卵です。卵子や精子のエピゲノム情報はどのように整えられ、子どものために準備されているのか。そこで何が起こっているのかという問いの多くが今なおブラックボックスであることが、この研究の醍醐味であり面白さですね」