
免疫細胞のT細胞はがん細胞を攻撃する性質を持つ。一方、がん細胞にはT細胞の攻撃をかわす免疫チェックポイントと呼ばれる仕組みが備わっている。免疫チェックポイント阻害薬は、その仕組みにブレーキをかけることでT細胞を活性化させ、がん細胞を死滅させる。ただ、効く患者と効かない患者の差が大きく、その理由は長らく不明だったが、がん細胞が自らのミトコンドリアを免疫細胞に送り込んで入れ替え、T細胞の働きを制限することが明らかになった。
イラストレーション/北澤平祐

免疫細胞のT細胞はがん細胞を攻撃する性質を持つ。一方、がん細胞にはT細胞の攻撃をかわす免疫チェックポイントと呼ばれる仕組みが備わっている。免疫チェックポイント阻害薬は、その仕組みにブレーキをかけることでT細胞を活性化させ、がん細胞を死滅させる。ただ、効く患者と効かない患者の差が大きく、その理由は長らく不明だったが、がん細胞が自らのミトコンドリアを免疫細胞に送り込んで入れ替え、T細胞の働きを制限することが明らかになった。
新たながん治療として注目を集めているのが、免疫チェックポイント阻害薬などのがん免疫療法である。この分野は、京都大学の本庶佑特別教授が礎を築き、2018年にはノーベル生理学・医学賞を受賞したことで広く知られるようになった。がん免疫療法は、がん細胞の周囲に存在するTリンパ球(腫瘍浸潤リンパ球:TIL)と呼ばれる免疫細胞に働きかけ、それらを活性化させてがん細胞を攻撃させる治療法である。ただし、すべての患者に効果があるわけではなく、奏効率はおよそ2割程度にとどまる。なぜ治療が効く人と効かない人がいるのか——その理由は長らく未解明であった。
こうした中、2025年1月に科学誌Natureに発表された岡山大学らの研究グループによる論文が、世界的に大きな注目を集めている。がん細胞が自らの異常なミトコンドリアを免疫細胞に送り込み、T細胞の働きを弱めることで、免疫療法の効果を妨げているという新たな仕組みを世界で初めて明らかにした。
ミトコンドリアは、細胞内でエネルギーを産生する小器官であり、生物のエネルギー源になる成分を合成する。細胞の核にあるDNAとは異なる独自のDNA(ミトコンドリアDNA)を持つ。
研究代表の岡山大学大学院医歯薬学総合研究科、冨樫庸介教授はこう話す。
「私たちの研究により、がん細胞のミトコンドリアDNAとまったく同じ変異が、周囲の免疫細胞にも見つかることが明らかになりました。これは、がん細胞のミトコンドリアが免疫細胞に移動し、さらに入れ替わっていることを示唆していると考えました」
冨樫教授がこの研究を最初に行ったのは2020年くらいのことだ。着想のきっかけは、冨樫教授が参加したセミナーで耳にした「ミトコンドリアが細胞間で移動する」という研究報告であった。
「最初は、本当にそんなことがあるのか、と半信半疑でした。ただ、もしそれが事実であるならば、がん細胞と免疫細胞の間でも同じような現象が起きている可能性があるという仮説を立てました」
ミトコンドリア研究は当初、冨樫教授にとって専門外の領域であったので、専門家にも教えてもらいながら、一つずつ研究を積み上げていった。
「ミトコンドリアは古代の細菌で、有核細胞に10億年以上前に侵入してきたものとされています。なので、オリジナルのDNAを持っていて、1細胞の中に100~1000個も入っているものです。一般的にがんゲノムを解析する際には、そのデータはほとんど注目されていませんでした。でも、私はミトコンドリアに関心があったので、国立がん研究センターの共同研究者にミトコンドリアDNAも読んでください、と他の研究のついでに解析してもらったのが始まりです」
その結果は驚くべきもので、約4割の症例において、TILでミトコンドリアDNAに変異が見つかり、多くががん細胞と共有されていることが明らかになった。
「データを見たときに、これは絶対にミトコンドリアが動いていると感じました」
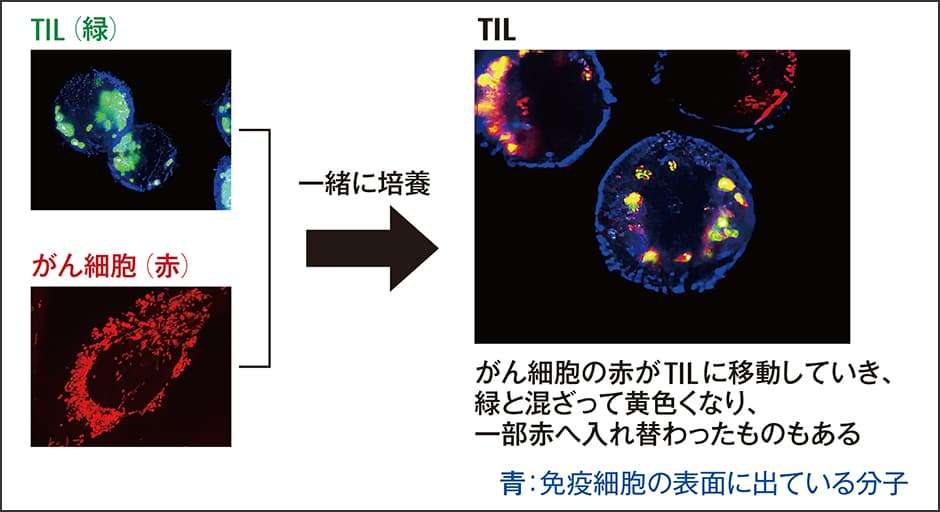
これを証明するために、冨樫教授らは、がん細胞のミトコンドリアを赤、TILのそれを緑に蛍光標識し、両者を共培養して顕微鏡で観察した。その結果、赤いミトコンドリアが緑のミトコンドリアに移動して中に入り込む様子が映像として捉えられたのである(図1)。TILの一部は元々持っていたミトコンドリアが減り、がん細胞から来たミトコンドリアに入れ替わった。
 岡山大学プレスリリース(2025年1月20日)を基に改変
岡山大学プレスリリース(2025年1月20日)を基に改変
図1 ミトコンドリアの移動TILのミトコンドリアを緑、がん細胞のミトコンドリアを赤に色付けして観察したところ、がん細胞のミトコンドリアがTILに移動し、混ざったり入れ替わったりする現象を見ることができた。
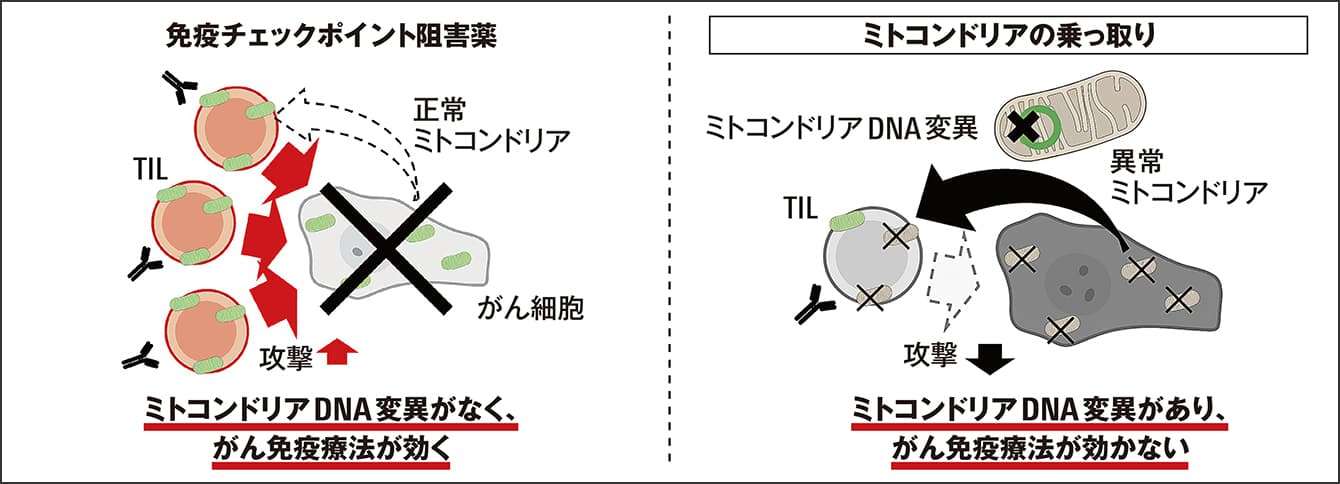
「これは、がんによる免疫系の乗っ取りといえるでしょう。つまり、がん細胞が異常なミトコンドリアをTILに送り込んで乗っ取ってしまうことで、TILの働きを妨げ、免疫システムから逃れようとしていることが明らかになりました」(図2)
 岡山大学プレスリリース(2025年1月20日)を基に改変
岡山大学プレスリリース(2025年1月20日)を基に改変
図2 がん免疫療法の効果を弱める仕組みがん細胞は変異したミトコンドリアDNAを持つ異常なミトコンドリアをTILに送り込み乗っ取ることで、T細胞のエネルギー産生能力を弱め、免疫システムから逃れようとしている。
がん細胞は、ミトコンドリアをエキソソームやトンネルナノチューブといった細胞間通信機構を通じて免疫細胞に移すことにより、T細胞のエネルギー産生能力を低下させ、免疫攻撃をかわしていたのである。
ミトコンドリアが移動し、さらに入れ替わるという現象を世界で初めて解明したことで、がん免疫療法が効かない人がなぜいるのかという謎の一端が、明らかになったのである。
研究グループはその原因として活性酸素が関与していると考えた。活性酸素を取り除く薬を使うと、ミトコンドリアの入れ替わりが抑えられたという。また、T細胞のミトコンドリアが障害されたマウスでは、がん免疫療法が効きにくくなるだけではなく、免疫チェックポイント阻害薬で治療した後に、腫瘍が再びできやすくなることが示されたという。さらに、がん組織の中のミトコンドリアDNAに変異がある場合は、治療効果が長続きせず、生存率が低いことも分かった。
このような画期的な研究を、冨樫教授は開始してから5年余りで論文として発表した。なぜそのようなスピードで世界初の研究が可能になったのか。
冨樫教授は京都大学医学部に入学してすぐに、分子生物学の授業として本庶教授の講義を受講したことがあったという。
「贅沢な話ですが、そのときの話はB細胞のクラススイッチという本庶先生が論文で報告したばかりの最先端の話でした。なんの知識もない私たち学生でしたが、今でもよく覚えています。教科書に書いてある内容は、極論を言えば自分で読めばいいですし、今となってはChatGPTなどのAIが簡単に説明してくれます。本庶先生は、既存の知識にないようなその先の研究の姿を見せてくれたのだと思います」
ただし当初、冨樫教授は研究の道は考えておらず、呼吸器内科の臨床医の道を選んだ。人生が変わったのは医師になって5年目くらい、2004年に報告された分子標的薬イレッサに関しての論文を精読したときだった。臨床現場でイレッサがよく効く人と効かない人がいることに疑問を持っていた。その論文では、イレッサはEGFRという遺伝子変異を持つがん患者だけに効くという事実が報告され、大きな反響を呼んだ。
「この報告は臨床の現場から発見されたものでした。自分も同じように臨床の疑問を科学で解き明かしたいという思いが芽生えたのは、そのときだったと思います。効いた/効かないを日々繰り返していても、サイエンスは進みません」
この出来事をきっかけに、冨樫教授は臨床の現場を一度離れ、2012年から大学院に進学して本格的に研究の道へ進んだ。他の誰もやっていないオリジナリティのある研究をしたいと考えていた。
順風満帆に見える研究だが、最初にNatureに論文を投稿したときには、レビューコメントで「長文にわたってまあまあ批判された」という。
「面白いけど堅いデータが必要、というような内容でした」
これまで報告のない現象で、もっと堅いデータを示さなければならないと再分析に取り組み、なぜTILの機能が低下するかについて1年弱で新たなデータを出した。
そしてレビュアーから最も指摘されたのは、「乗っ取り」の部分だ。
「1つの細胞に100も1000もあるミトコンドリアDNAがたった1個、がん細胞から移動して入ってきたところでたいしたことないと思うじゃないですか。1、2個であれば、何も起きないはずなのに、僕らの遺伝子解析のデータだと8割以上ががん由来に入れ替わっているものもありました。だいたい6割くらい変異が入れば機能が落ちるといわれていたので、そこまで入れ替われば機能は落ちます」
まさに乗っ取りといえる事態だが、これまでの常識を覆すためには十全の説明が必要だった。
「僕も最初はミトコンドリアの素人だったから、それぐらいあってもいいんじゃないかと安易に思っていました。ただ、深く考えるとやっぱり入れ替わるというのはおかしな話で、なぜ入れ替わるんだというのが一番指摘されたところでした。このメカニズムについて部分的に説明はつきましたが、今はさらに根源的な解明を進めているところです」
研究の推進力は「知的好奇心だ」と冨樫教授は言う。
細胞には、ミトコンドリアに選択的に働くオートファジーの一種であるマイトファジーという処理機構が存在しており、DNAが変異している異常なミトコンドリアは残さないはずである。それなのに異常なミトコンドリアが残ったままになっているのはなぜか。
「さらに不思議なのは、ミトコンドリアDNAに変異がある細胞は一般的に成長が遅い。それにもかかわらず、100個とか1000個とかほぼすべてが変異してしまうのは変じゃないですかね。不利なことをわざわざする必要はありませんから、細胞にとって、これは有利な何かが起きていて、引き継がれているのかもしれません」
今後根源的なメカニズムが見つけられれば、何らかの治療や病態の解明にもつながる可能性があるという。
「がんだけではなく、例えば炎症性の疾患みたいなものでもこの乗っ取りが起きている可能性があると考えています。僕は呼吸器内科医なので、例えばタバコで肺が壊れてしまう炎症性の慢性閉塞性肺疾患(COPD)や間質性肺炎にも関係があるのではないかと研究を進めています」
「ミトコンドリアを元気にする薬を使えば、活性が上がるのではないかと考えられています。例えば、遺伝子を入れた細胞を作るなどの細胞療法とか、移植という方法も考えられます。機能が落ちているものに対して機能を上げてあげれば、がんだけではなく、さまざまな治療法につながるでしょう。これは発がんにも関係しているのではないかと考えて、我々は研究を進めています」
今回の発見は、今後ミトコンドリアをターゲットにした新しい治療法の開発につながる可能性がある。例えば、がん細胞が免疫細胞に送り込んでしまう異常なミトコンドリアの動きを抑える薬や、免疫細胞のミトコンドリア機能を回復させる治療などが考えられるという。また、患者のがん細胞やTILのミトコンドリアDNAを解析すれば、どの程度のミトコンドリアの乗っ取りが起きているかを把握できる。これにより、免疫療法が効きやすいかどうかを事前に見極める指標としても応用できる可能性があるだろう。効きにくい人は別の治療法を選択すれば、生存率が高められる可能性もあるだろう。冨樫教授は基礎研究とともに、臨床の教授も兼任している。それは若い人たちにも新たな研究に夢を持ってもらいたいからだという。
「学生さんにはいつも言っていますが、必要であることは理解していますが、日常診療だけをしていては、なかなかサイエンスの発展はないということです」
医療は「箱」だという。ガイドラインといった「箱」から大きくはみ出ることは、患者の安全のためにも行うことはできない。けれどもサイエンスの発展のためには「箱から出る研究が必要だ」と話す。
「単純計算すると、多分今のこの国の共通テストの成績上位1%くらいの人たちがこぞって医学部に行っていると思います。そんな優秀な臨床医たちが日常診療に忙殺されてしまい、考えることを放棄して医療という箱の中だけに収まってしまうことがあっては、サイエンスの発展はなく、社会的に言えば大きな損失だと思っています。臨床を行っているからこそできる研究がある。だから、僕のもう一つの目標は自分の研究とともに、箱の中の人たちを一部でもいいので外に出して自由に研究してもらうことです」