
アルツハイマー病は、多くの遺伝子の小さな作用の集積により、病因であるタンパク質が蓄積していくということはわかっている。ではなぜ、どのようなメカニズムで発病するのか―この難題について調べる有効な手法はこれまでなかったが、患者の血液細胞から作ったiPS細胞を脳の神経細胞に成長させ、病気を細胞レベルで再現することに成功。遺伝子の分析が培養皿の中で可能になった。言うなれば、iPS細胞を使えば病気のモデルは無限にできるという。
イラストレーション/北澤平祐

アルツハイマー病は、多くの遺伝子の小さな作用の集積により、病因であるタンパク質が蓄積していくということはわかっている。ではなぜ、どのようなメカニズムで発病するのか―この難題について調べる有効な手法はこれまでなかったが、患者の血液細胞から作ったiPS細胞を脳の神経細胞に成長させ、病気を細胞レベルで再現することに成功。遺伝子の分析が培養皿の中で可能になった。言うなれば、iPS細胞を使えば病気のモデルは無限にできるという。
世界保健機関(WHO)は世界の認知症有病者数が、2050年には1億人を突破するという報告書を発表した。認知症とは、記憶力や判断力が低下する脳の病気であり、2011年時点での世界の認知症有病者数はおよそ3560万人という。それが2030年までに2倍近くの6570万人、2050年までには3倍以上の1億1540万人に増えると予想した。2050年の世界の人口は91億人とされており、約100人に1人が認知症を発症する予想となる。
しかし、この推計には留保が付いている。「有効な対策を何もしなければ」ということだ。世界中の研究者がこの病気に取り組んでいるが、有効な対策のための研究の最前線を走る一人が、京都大学iPS細胞研究所(CiRA)の井上治久教授である。
認知症の原因となる疾患で最も多いのがアルツハイマー病である。井上教授らの研究チームは2022年2月、アルツハイマー病患者から作ったiPS細胞を使い、病気に関わる複数の遺伝子を同定したと発表した(図1)。
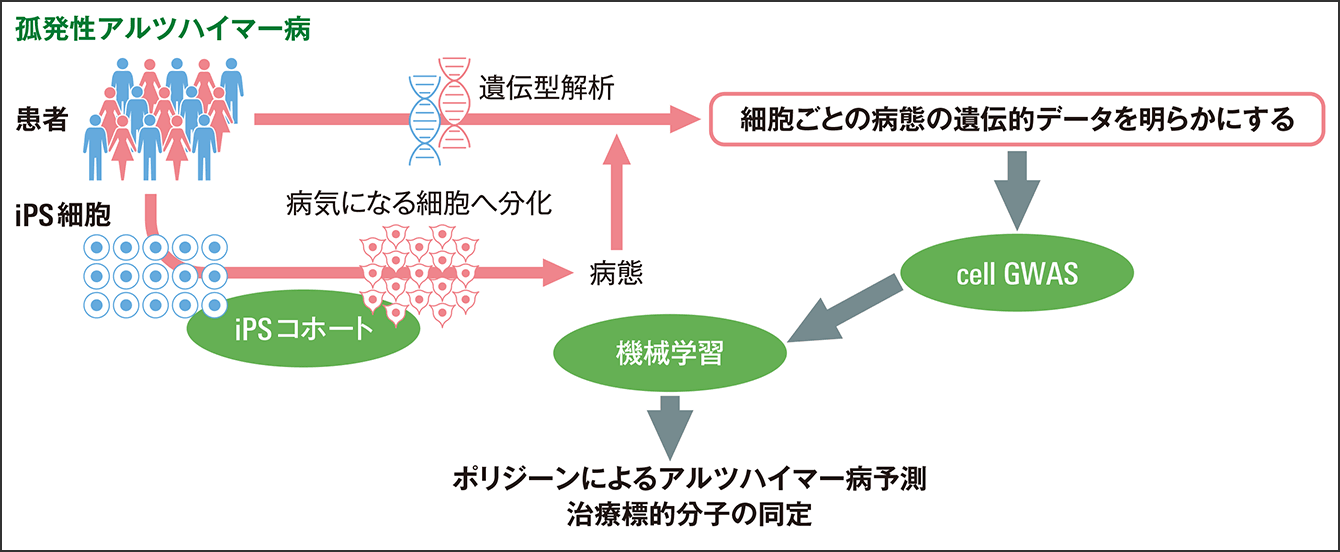
図1 CDiP(Cellular dissection of polygenicity)テクノロジーによる病態の再構成「CDiP(Cellular dissection of polygenicity)テクノロジー」という新技術で、iPS細胞から神経細胞を作製し、アルツハイマー病の病態を分解し、その背景の遺伝子データからアルツハイマー病の実際の病態を再構成した。
「僕たちが研究しているのは神経変性疾患、具体的には脳とか脊髄の細胞が減っていく病気です。がんは細胞が増えていきますが、それと全く逆で減っていく病気となります。そのなかでも、最も罹患されている方が多くて、今後も増えるであろう病気がアルツハイマー病です」
アルツハイマー病は大きく分けると家族性と、家族に病歴のない孤発性があるが、9割以上が孤発性だという。
「僕らの研究テーマは、孤発性の方々になぜそういう病気が発生するかです。アルツハイマー病は脳内に特定のタンパク質が過剰に蓄積されることが原因だということはわかっていましたが、なぜ病気が起こるかという部分は非常に難しい問いでした」
そこで鍵となるのが「ポリジーン仮説」だという。「ポリ」は多いという意で、ジーンは遺伝子を指す。家族性の場合はある遺伝子の配列が1つ違うだけで必ず病気になるというが、孤発性の場合はある1つの遺伝子の関与ではなく、いろいろな遺伝子の変異が関与している。1つの変異が病気を起こす力は弱くても、それが集まってくると病気になるという仮説だ、と井上教授は言う。
「ポリジーンをどうやったら同定できるのかが1つの課題でした。これまでにポリジーンを同定する方法としては、ゲノムワイド解析(GWAS)という遺伝子を調べる方法がありまして、バーコードのようなもので、ヒトの遺伝子に印をつけて、アルツハイマー病の方とそうではない方の印を分類していました。しかし、これではなぜ病気になるのか、何が治療の標的になるかまではわかりませんでした。そこで僕らは別の方法を考えました。アルツハイマー病の病気の分子の最上位にあるアミロイドβという物質には善玉と悪玉がありますが、神経細胞で悪玉と善玉の比率が高い人の数字を連続値で出して、その連続値に関連している遺伝子を同定したというのが僕らの見いだしたことです」
これまでは細胞レベルで調べる手法がなかったが、井上教授らは患者の血液細胞から作ったiPS細胞を脳の神経細胞に成長させ、病気を細胞レベルで再現することに成功、細胞の遺伝子を分析した。
「3000万個から、まず496個の遺伝子を同定しました。しかし、iPS細胞から同定したものって本当にそうなの?という疑問があるかもしれません。僕たちもそう思いました。そこで今度は、過去に500人の患者さんを集めて、遺伝子、アミロイドβについて解析したADNI(Alzheimer’s Disease Neuroimaging Initiative)とJ-ADNI(Japanese Alzheimer’s Disease Neuroimaging Intiative:日本におけるアルツハイマー病脳画像診断法の先導的研究)という大規模コホート研究のオープンデータと比較させていただきました。496個の遺伝子によりアミロイドβが脳にたまるかどうかを予測できるかを機械学習というAIで調べたところ、感度・特異度から計算されるカーブの面積AUC(Area Under Curve:人工知能の評価指標)が76%という高い確度で予測できることがわかりました。単に培養皿の中での結果ではなく、現実のデータで予測できるということが一番重要なことです」
井上教授は、今回調べた神経細胞とアミロイドβの組み合わせ以外にも、いろいろな組み合わせ、例えば神経以外の細胞とか、他の物質との組み合わせを調べていくと、もっとAUCが上がっていく可能性があると話す。
井上教授は、さらに遺伝子を絞り込んだという。
「496個の遺伝子から、さらに統計学的に有意差が強いものを選んだところ24個の遺伝子を特定しました。そのうち8個の遺伝子はアミロイドβの量の調整に関わることもわかりました。それが何を意味しているのかといえば、その遺伝子を上げたり下げたりすると、アミロイドβが増えなくなる。つまり治療標的分子になる可能性があることがわかったのです」
さらに、この24個の遺伝子のうち、1つは家族性のアルツハイマー病に関わる遺伝子であることを特定できた。これは、その遺伝子を持つ人に特徴的な治療法を提案できることを意味すると、井上教授はいう。
「この遺伝子を持っている方に、特に有用な薬がわかれば、治療につながります。すでにこの遺伝子については既存薬の応用という観点から研究が進んでいます」
遺伝子を調べると、将来アミロイドβがたまるかどうかが、AUC76%で予測できるというのは大きな発見だろう。倫理的な問題は除いて、理論上は赤ちゃんを調べても、将来アルツハイマー病の脳の特徴を有するかどうかが予測できるという。
「100%ではないにしても、遺伝子の情報を使って早く予測できることが、治療法の開発にとって非常に重要です。細胞がなくなってしまう病気なので、いかに早期診断するかにかかっているからです。我々の方法が、少しでも早期診断と、治療法開発に貢献できればと思っています」
ここでいう「治療」とは何を指すのか。アルツハイマー病で、神経細胞がなくならないように止めるのか、細胞を増やすのか、あるいは原因の遺伝子をなくそうとするのか。
「病気の遺伝子を持っていても、今の状況がどんどん悪くなったときに初めて症状は出ます。まずは、この神経細胞が少なくなることを抑えることに着目するのが1つの解決策だと思います。現在、悪くなるカーブをできるだけ緩やかにしようという治療法開発が行われていますが、もっと早い段階で治療ができれば、病気自体を根絶することができるかもしれません。一方で、細胞の量を増やして元に戻すことは、アルツハイマー病の場合、現在はまだそういう方法がないのが事実です。しかし将来、減ってしまった細胞を元の通りに増やすという研究も進んでいく可能性があります」
本研究もそうだが、再生医療としてのiPS細胞ではない新たな利用法が大きく注目を集めるようになった。
「iPS細胞には2つの使い道があると思います。1つ目は誕生したきっかけである細胞移植による再生医療で、病気の部位にiPS細胞で正常な細胞を作って移植すれば治るかもしれないという考え方です。一方で僕らはそれとは違った使い方をしていて、それが2つ目の、iPS細胞を病気の人から作らせていただいて、病気の方の病気になる部分を培養皿の中で作る使い道です。そうすると、培養皿の中で病気のモデルができます。iPS細胞は無限にできますから、無限に病気のモデルができ、いろいろな薬を試すこと、スクリーニングすることができます(図2)。そういう方法で薬を探索し、実際に患者さんにご協力いただき、2020年より家族性アルツハイマー病を対象とした臨床試験をさせていただいています」
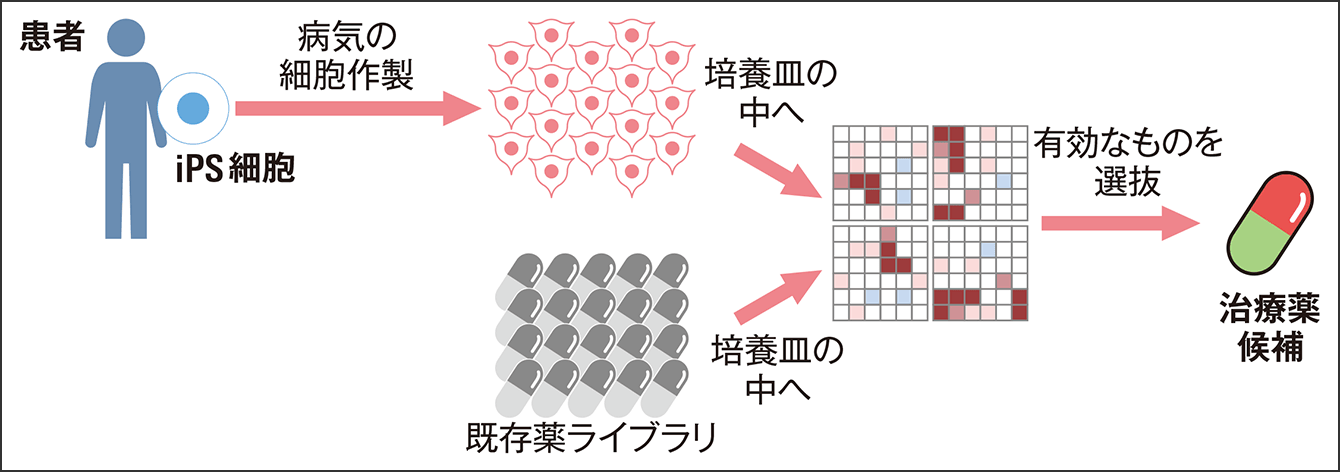
図2 iPS細胞を用いたドラッグリポジショニングiPS細胞の使い道は、再生医療だけでなく、ある病気の薬を別の疾患に利用するドラッグリポジショニングの研究においても期待されている。
2010年から2012年ごろまでは、iPS細胞から作った神経細胞が病気のモデルとして使えるかという研究に取り組んだという。以降、それらのモデルを多くの患者から作製し、薬の効果を調べ、スクリーニングする研究を行ってきた。
2019年より井上教授らが、全身の筋肉が衰える筋萎縮性側索硬化症(ALS)について、iPS細胞を使った創薬研究で見つかった候補薬を患者に投与する臨床試験を開始している。少数例の方を対象とした第1相試験では、一部の方で短期間では進行の停止が見られたことが、2021年に発表された。ここで使用されたのは、慢性骨髄性白血病の治療薬「ボスチニブ」だという。
その上で、今回アルツハイマー病の研究で、多くの患者や共同研究者の協力のもとに、世界で初めて、大規模な人数の患者のiPS細胞を作製し、さらにそのiPS細胞から神経細胞を作製し、そのデータを取り出して、臨床の実際のデータと合わせて検証するということができたと井上教授は話す。
井上教授は京都大学医学部卒業後に、神経内科医として臨床経験を積んだ。出会った患者さん一人ひとりを今でも覚えているという。
「京都大学医学部附属病院での研修後に、大阪の住友病院で研修させていただきました。亀山正邦院長は脳神経内科医で、世界の最新論文にいつも目を通されていました。神経難病の高齢者の方は誤嚥性肺炎を起こされやすいのですが、血圧の薬を使うと誤嚥性肺炎を起こしにくいという最新の論文のデータを教えてくださり、また、すぐに臨床に生かされていました。薬というのは対象の病気だけではなく、別の疾患にも応用できるという考え方、今でいうドラッグリポジショニングの考え方を身をもって学ばせていただきました。このようなアプローチを現在の研究に用いています」
井上教授は、iPS細胞を用いてドラッグリポジショニングができないか、これまでずっと探索して、これまでのALS、家族性アルツハイマー病の研究においても、ドラッグリポジショニングを進めている。
今後の、治療法についても1つの方法ではなく、組み合わせることが重要だという。
「がんの領域は最も進んでいる医学領域で、治療法として手術、化学療法、免疫療法、放射線療法など、組み合わせることによる集学的治療が知られています。まだ治療法が確立されていない脳神経領域でも、同様に進んでいくのではないでしょうか」
それにしても、どうして病気になる遺伝子、特にアルツハイマー病になる遺伝子を、これほど多くの人が持っているのか。
「生物の多様性というものが究極の答えになるでしょうか。生物は多様性を維持するように生存してきました。それは、いろいろな組み合わせを持っているほうが、種としての生存に有利だからではないでしょうか。たまたまある遺伝子を持つ方がある病気になられますが、病気以外の面もあるのではと思います」
しかし、アルツハイマー病の予測や治療法の確立が重要になってくる。
病気の予測や治療法開発への大きな一歩となった研究だが、どうしてこのような独創的な研究ができたのか。
「良い研究かどうかは、今後の進展によるところが大きいと思いますが、良いチームメンバーとの出会いに感謝しています。また、時代もあるでしょう。iPS細胞との出合い、いろいろな科学的な発見との出合いもあるかと思います」
井上教授は自分に課していることがあるという。
「新たな視点で物事を見ることと、自分のこれまでの研究さえもできるだけ踏襲しないことができればと考えています。そうすることが正しい方法かはわかりませんし、大変で厳しいのですが、ぜんぜん違うものを創るため、そう心がけています」