血管は細胞や組織に栄養や酸素を運ぶ役割を持つ一方で、血管内皮細胞そのものが分化・増殖する過程(血管形成)では、組織の維持に寄与する物質を分泌したりして体の恒常性を保つ。また、がんが増殖を繰り返すことができるのは、もともと血管がなかった細胞に血管を新生させ、栄養をどんどん取り込むからだ。血管の異常はCOVID-19などの感染症やさまざまな病気と深く関連するともいわれている。血管形成の解明は、疾病治療の新たなアプローチとなるに違いない。
特集 血管を知る 「血管形成」の解明は疾病治療の新たな扉を開くか
構成/飯塚りえ イラストレーション/小湊好治
血管研究において、主要なテーマの一つに血管形成があります。どのように血管ができるのか、その機序を解明しようというものです。
血管と血液を一気につくる脈管形成
血管の形成には2種類あり、一つが「血管新生」です。これは、すでに体内に存在する血管から芽が伸びて新しい血管を形成するというシステムで、樹木の芽に例えて発芽ともいわれます。成長後は、性周期に応じて子宮内膜で定期的に起きるほか、ケガを治そうというときにも血管新生が起こります。それ以外で起きることはほぼありません。
ところが、がんでは、もともと血管のなかった細胞に血管新生が起きて周囲の血管からどんどん枝が伸び、栄養を取り込んでがん細胞が異常な増殖を繰り返すようになります。血管新生の仕組みを解明し、がん血管を抑制することができればがんの治療にもつながるとあって、盛んに研究が行われている分野です。
血管形成のもう一つのルートが、胎生期に血管芽細胞が分化して形成される「脈管形成」です。
胎児の頃、その近くには栄養補給のための卵黄嚢という膜があります。図1はその部分の血管形成の様子です。たくさんの丸い点は「血島」と呼ばれ、中胚葉由来の細胞が100個ほど集まって固まりをつくっています。これらの島は、段々と数珠のようにつながり始め、1本のひものようになって、そのうち外側の細胞が血管内皮細胞に、内側の細胞が血液に分化していきます。脈管形成は、胎児の発生初期に血管と血液を一気につくる、なかなか合理的なシステムです。胎生期に起こり、成長後に起きることはほぼないと考えられています。
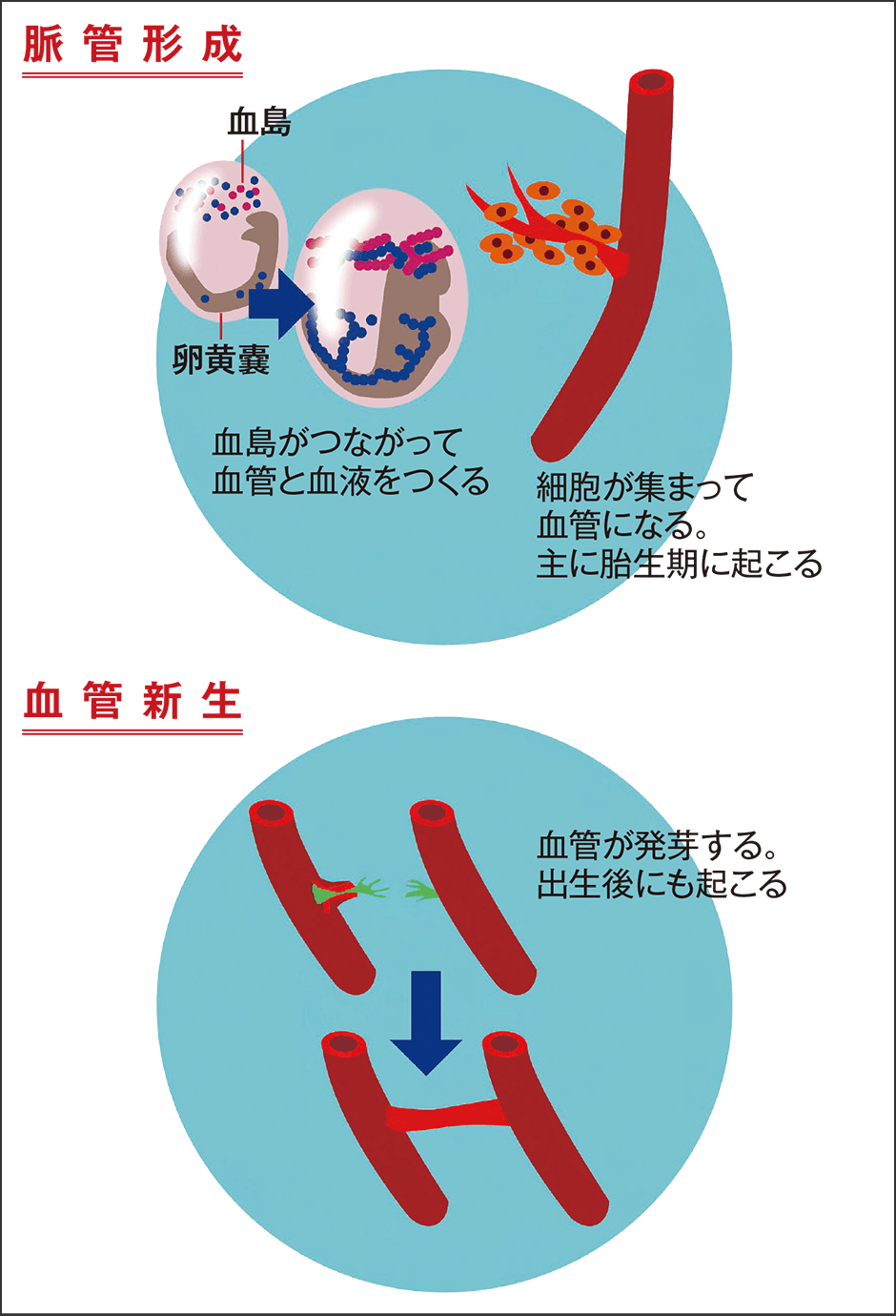
図1 2つの血管形成脈管形成の場合は、中胚葉由来の細胞の分化によって血島ができ、それがひものようにつながり、そして血管と血液がつくられる。既存の血管から形成される血管新生とは異なる機構。
脈管形成、血管新生、いずれの機構でできた血管でも、その後に血管そのものの形態や毛細血管などの血管網がきれいに整形されていきます。これは「血管リモデリング」と呼ばれています。
図2は、マウスの皮膚における血管リモデリングの様子です。まず太い血管が無造作に形成され、それを起点に血管新生によって毛細血管のネットワークが各々できていきます。最初はまだ血管はバラバラに走っていますが、徐々に、動脈(図で黃色の線)と静脈(同、青色の線)が並走し始め、機能的に成熟した血管へと変化していきます。この様子はヒトもマウスもほぼ同様と考えられています。
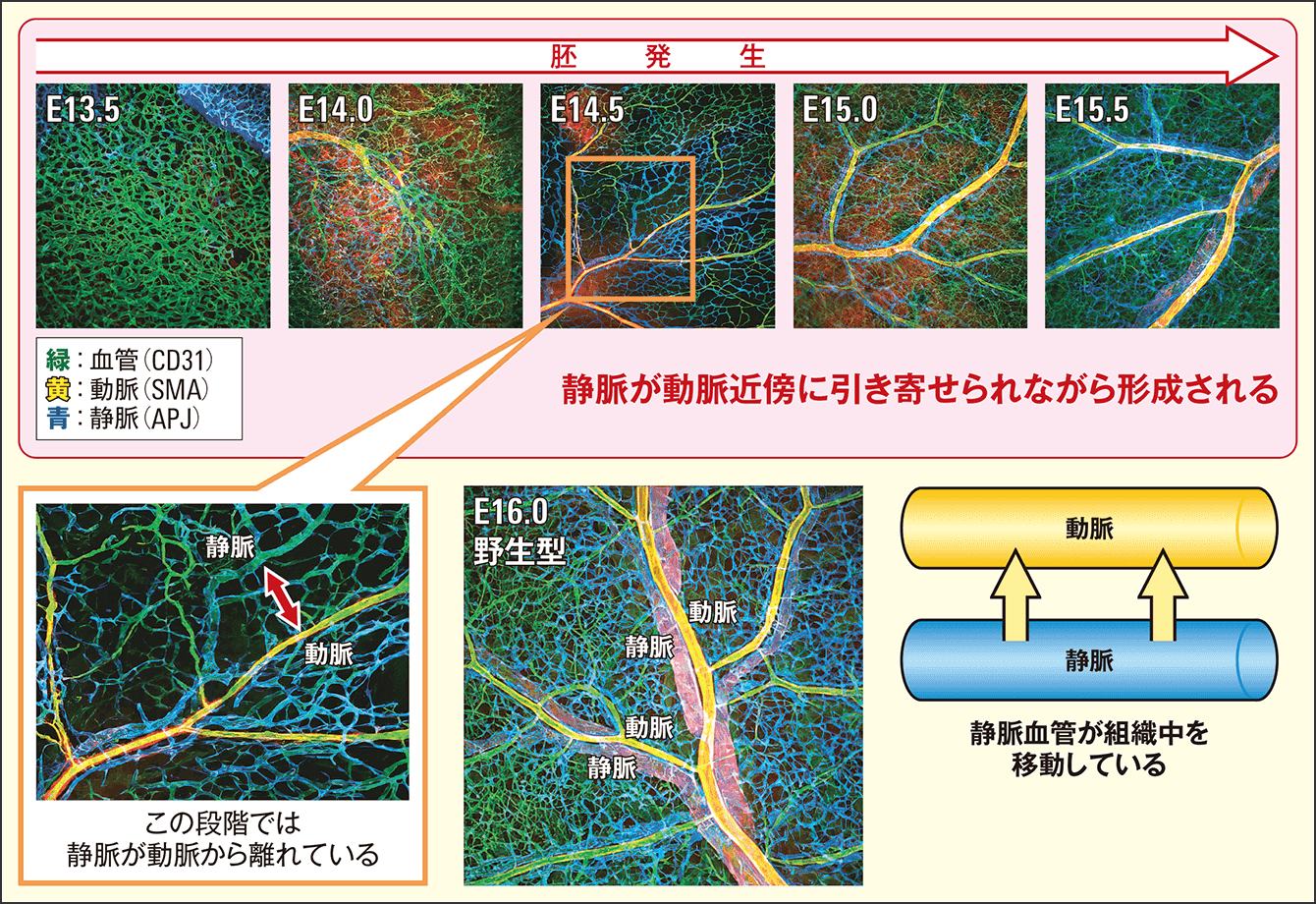
図2 マウスの血管リモデリング胎児の期間が約20日間のマウス。受精後7.5日から8.5日くらいで血管が少しずつ形成され、9.5日で心臓が動きだして血流が観察できる。13.5日でも血管のネットワーク構造は未熟。少しずつ動脈と静脈が近づいて最後に並走する。
ベルギーの解剖学者アンドレアス・ヴェサリウスは、ヒトの全身の血管を世界で最初にスケッチし、1543年に発行した解剖学の古典『ファブリカ』にも、体中の動脈と静脈がきれいに並走する構造を描きました。しかし、血管がなぜ、動静脈が並走する構造を取ることができるのかという疑問は、今も解明されていません。そこで私たちのチームでは、まず、どういったタイミングで動脈と静脈のこうした並走ができあがるのかを調べました。
血管新生で重要な役割を果たす物質
図2の受精から13.5日目(E13.5)の胎児の皮膚を見ると、体はそれなりに成長している頃ですが、この時期でも、まだ血管の構造は混沌としています。それが14.5日(E14.5)ごろになると、静脈が動脈に引き寄せられるように近づき、少しずつ並走していきます。
私は、バラバラに存在した動脈と静脈が並走するようになるには、動脈と静脈の間に、リガンドと受容体のようなインタラクションのシステムがあるのではないかと考え、アペリンという生理活性オリゴペプチドに注目しました。アペリンは、さまざまな組織に発現しますが、血管新生でも重要な役割を果たすことが知られています。
血管が並走する際のアペリンの発現を見たところ、動脈においてアペリンが、静脈においてはアペリンの受容体であるAPJが発現していることが認められました(図3)。この観察から、動脈から分泌されたペプチドが静脈の受容体を刺激し、静脈が移動していると考えられます。検証のためにアペリン、APJそれぞれを発現しないノックアウトマウスで観察したところ、静脈は移動せず、動静脈は並走しませんでした(図4)。
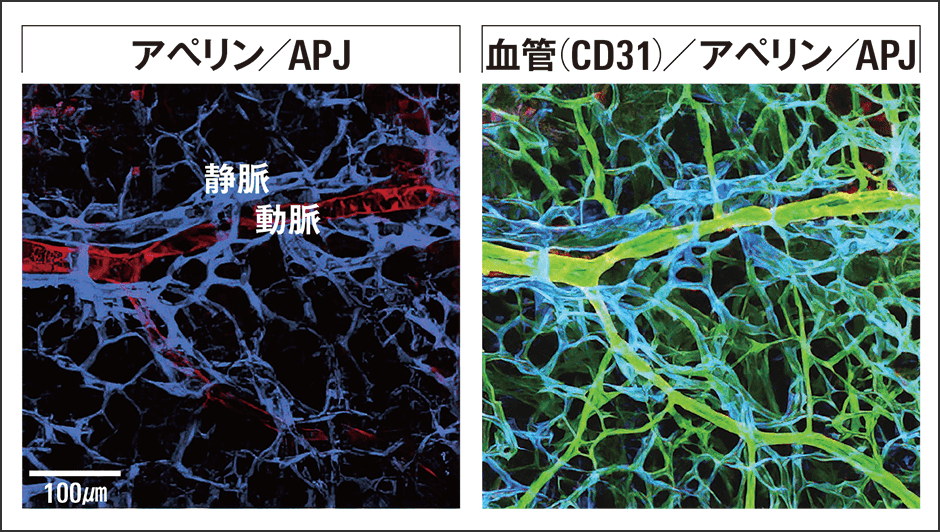
図3 動脈と静脈の並走プロセス動脈側にペプチドのアペリン(赤)が、静脈側にAPJ(青色)という受容体がそれぞれ特異的に発現し、アペリンがAPJに作用している。
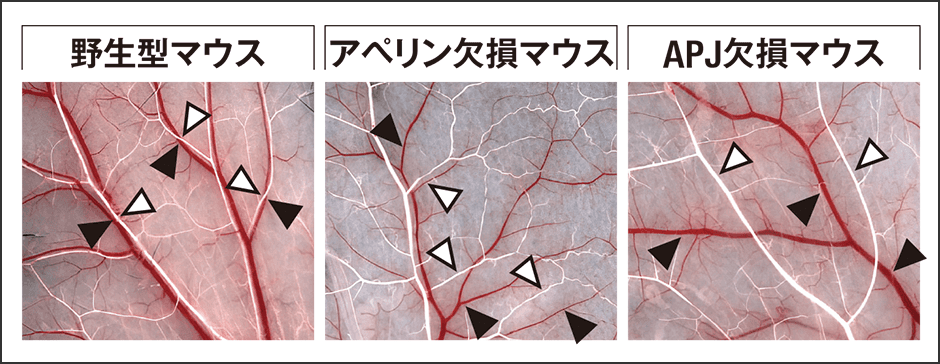
図4 アペリン、APJ発現の有無による血管網の違い野生型マウスは動脈(白)と静脈(赤)が並走しているが、アペリン、APJを欠損させたノックアウトマウスでは離れたまま。
私たちのチームでは、こうした血管の移動を、両者のインタラクションを介した「血管束移動」という現象として報告しています。
興味深いのは、ノックアウトマウスが野生型マウスと変わらない生活を送るということです。血管網が雑然としていても、一見、健康に影響がないように見えるのです。だとしたら、動脈と静脈が並走する理由は何でしょうか。
動静脈の並走が体温維持を担っている
実は、1948年の論文に、「対向流熱交換」という語を用いて、動脈と静脈の並走が体温維持に働いていることを報告するものがありました。外気温が高いときに血液が末梢に流れると、末梢で血液が外気温によって温められます。その血液がそのまま中枢に戻ると、深部体温が上がってしまいます。この論文では、それを防ぐために動静脈が並走して熱を移動させるという機構があるのではないか、と推測しています。
この仮定を検証するため、動静脈が並走する野生型マウスと離ればなれのノックアウトマウスを高温環境下に置き、体温の変化を測定したところ、ノックアウトマウスは体温上昇が早く、熱中症になるまでの時間も短いということがわかりました。逆に温度を低くすると、深部体温が野生型マウスよりも早く下がります。動静脈が並走することによって、体温が維持されるようです。
では、動物には、恒温動物と変温動物がありますが、これと動静脈の並走について見てみましょう。すると見事に、並走する種としない種の境界が鳥類とカエルの間にありました(図5)。このことからも、動静脈の並走が体温維持を担っていると考えられます。
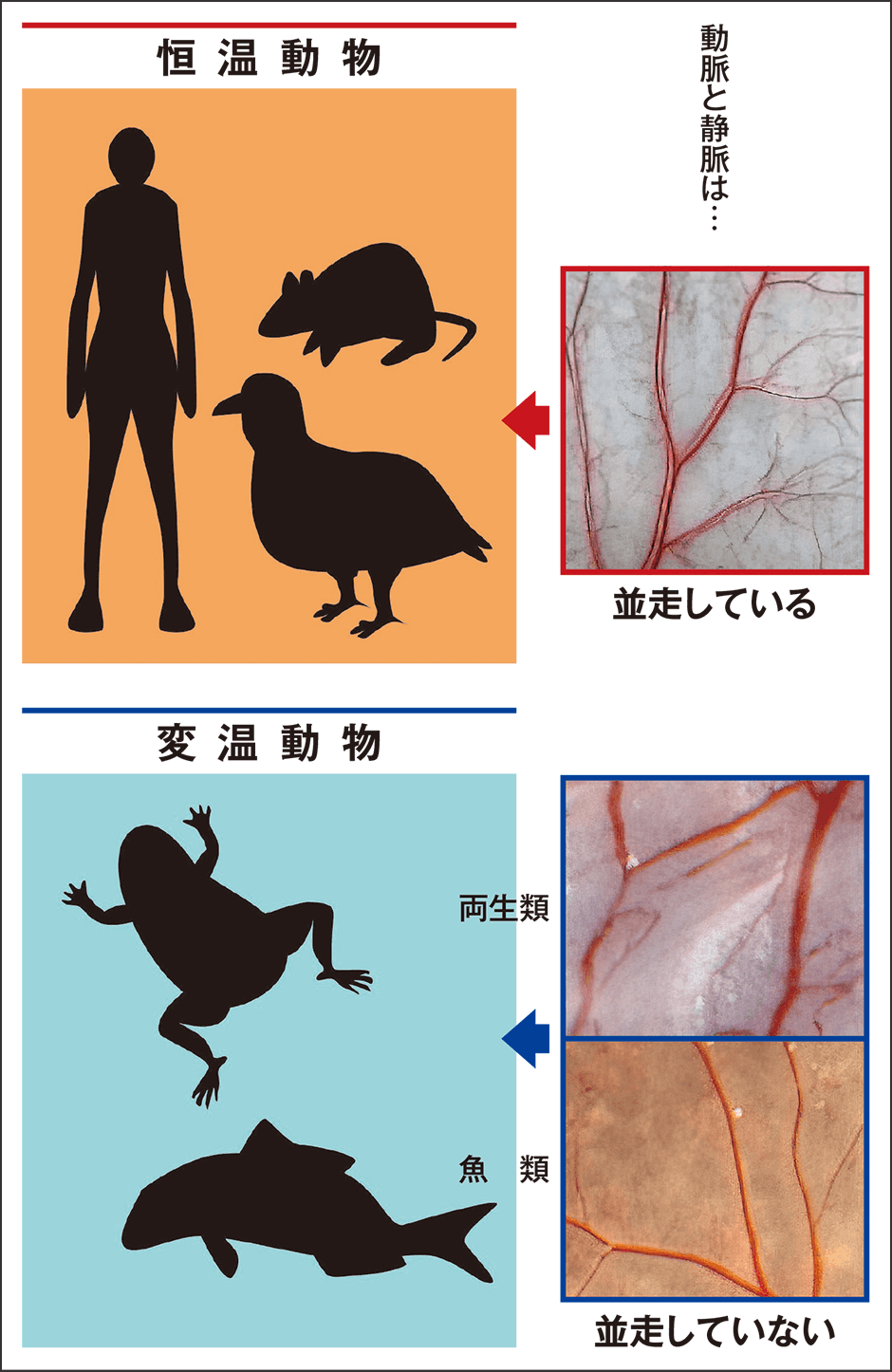
図5 動物種による血管網の違い恒温動物であるヒト、ネズミ、それに鳥類は動脈と静脈が並走している一方、変温動物であるカエル、魚は並走していない。
このアペリンは、血管内皮細胞から分泌される「アンジオクラインファクター(Angiocrine factor)」と呼ばれる各種の生理活性物質の一つです。血管には、栄養や酸素を運ぶパイプラインとしての機能とともに、ホルモン様の物質を分泌する臓器としての重要な機能もあるのです。
アンジオクラインファクターは、古典的には、アペリンのように血管内皮細胞から分泌されて、血管形成に働く分子とされていましたが、最近では、血管以外の近隣の組織に対して恒常性維持に働くことが明らかになりつつあります。
血管の様相は臓器によって異なります。それぞれ、組織特異的な血管内皮細胞から、組織特異的なアンジオクラインファクターを産生して、各組織の恒常性を維持しているのです。
例えば肝臓の類洞血管は、肝細胞増殖因子と呼ばれる分子を産生して、肝細胞の増殖・修復に機能しているとされていますし、よく知られているのは、血管ニッチという微小環境とそこで機能するアンジオクラインファクターです。
造血幹細胞は、普段は骨髄の血管に接して休眠しており、必要なときに血管の近傍で分化したり増殖したりして、血液細胞を産生していきます。その“必要なとき”のシグナルが、血管内皮細胞から分泌されるアンジオクラインファクターであり、造血幹細胞の休眠、分化、増殖をコントロールしているとされています。
これまで血管は、酸素を供給するために組織から数マイクロメートル以内にあるとされていましたが、それだけでなく、アンジオクラインファクターを産生して組織に指令するという側面からも、各組織と密に接して存在しているのは合理的です。
COVID-19でも血管の異常を確認
こうして血管の司令塔としての役割ががぜん注目されるようになってきたのですが、この機構は、病気のときにはどういった働きをしているのでしょうか。むしろ、血管の指令が狂うことで病気が進行することもあるのではないか、という疑問が浮かびます。
思いつくのはやはり、がんです。白血病になると、造血幹細胞が異常に分化していきます。造血幹細胞の場合、骨髄の血管内皮細胞が、増殖する時期、分化する場所などを適切に制御していますが、白血病のときには、血管が異常を来して、血管内皮細胞から「負の指令」が発せられているのではないかと考えています。実際、白血病のマウスの血管の状態を整えることで、病状の進行が抑えられるという結果が出ています。
この観察を鑑みると、がんの治療にも新しい視点が必要になります。血管が異常を来しているといっても、がん化しているわけではありません。ただ、何らかの異常な刺激ががん細胞から血管内皮細胞に伝わって、負の指令を出す物質を産生してしまうのではないか、と考えているのです。私はこれを「アンジオクラインスイッチ」と呼んでいます。
例えば、白血病は再発しやすいがんとされていますが、これまで、治療は白血病細胞を殺すことでした。しかし、白血病を発症したときに異常を来した血管はそのままですから、そのためにまた細胞ががん化するのではないか、と考えることもできます。
血管の異常は、がんだけでなく感染症など、他のさまざまな病気にも関わっていると考えられます。COVID-19でもやはり血管の異常を確認しています。血管の異常が先にあり、そのために感染症の症状が重くなるのか、症状が重いために血管にも異常が出るのかは定かではありませんが、少なくとも重症の場合、血管の異常も顕著です。COVID-19で異常になったアンジオクラインファクターの産生を正常に戻す薬剤を使用してみると、治療効果があるという実験結果も出ています。
ここでも、感染症になるとウイルスを退治することがターゲットになりますが、血管の状態を整えることで、血管内皮細胞から正のアンジオクラインファクターが分泌されれば、症状が軽減されることもわかってきています。
この他、糖尿病や老化に関しても、アンジオクラインスイッチを誘導する物質があると考え、探索しているところです。
パイプラインとしてスムーズに物質を供給することと同時に、適切なアンジオクラインファクターを分泌する臓器として、今後、血管の健康を保つことがいっそう重要な概念となると考えています。