免疫細胞療法は、がん細胞が持つヒト免疫システムから逃れるさまざまな機能を抑制する新しい治療法として期待されている。なかでもCAR-T/TCR-T細胞療法は、最新のゲノム編集技術を用いたバージョンアップも進み、難治性がん治療の“切り札”として注目される。しかし保険収載の細胞医薬品は海外産のため薬価が超高額となり、現実的に一般への普及は難しい。海外知財に頼らない日本独自の新基盤技術の開発とライセンス保護を、国家的レベルで進める必要があるという。
特集 ゲノム編集の真実 進化するがん免疫細胞療法 CAR-T/TCR-Tの期待と課題
構成/茂木登志子
手術・抗がん剤・放射線といった、従来の治療では効果が見込めないがん患者への“切り札”として、注目を集めている新療法があります。「CAR-T細胞療法(キメラ抗原受容体導入T細胞療法)」と「TCR-T細胞療法(T細胞受容体導入T細胞療法)」と呼ばれる免疫細胞療法です。
いずれも患者自身の免疫細胞であるT 細胞を改変し、患者自身の免疫システムを強化してがん細胞を攻撃する治療方法です。
日本では3349万円という薬価で保険適用
すでにCAR-T細胞療法は、2017年にチサゲンレクルユーセル(キムリア)がアメリカで薬事承認され、その2年後には過去最高額(当時)の3349万円という薬価で日本でも保険適用となりました。これにより、既存の治療方法が十分に奏功しない再発・難治性の血液がんにおいて、長期間の寛解が得られる患者が増加しつつあります。
現在では、リソカブタゲンマラルユーセル(ブレヤンジ)、アキシカブタゲンシロルユーセル(イエスカルタ)、イデカブタゲンビクルユーセル(アベクマ)、シルタカブタゲンオートルユーセル(カービクティ)というCAR-T療法も保険適用となっています。これらはすべて血液のがんに対する治療方法です(表)。
| 一般名 | 商品名 | 適応疾患 |
| チサゲンレクルユーセル | キムリア | 再発または難治性の、CD19陽性のB細胞性急性リンパ芽球性白血病・濾胞性リンパ腫・びまん性大細胞型B細胞リンパ腫 |
| リソカブタゲンマラルユーセル | ブレヤンジ | 再発または難治性の、濾胞性リンパ腫・びまん性大細胞型B細胞リンパ腫・原発性縦隔大細胞型B細胞リンパ腫・高悪性度B細胞リンパ腫・形質転換低悪性度B細胞性非ホジキンリンパ腫 |
| アキシカブタゲンシロルユーセル | イエスカルタ | 再発または難治性の、びまん性大細胞型B細胞リンパ腫・形質転換濾胞性リンパ腫・原発性縦隔大細胞型B細胞リンパ腫・高悪性度B細胞リンパ腫 |
| イデカブタゲンビクルユーセル | アベクマ | 再発または難治性の、多発性骨髄腫 |
| シルタカブタゲンオートルユーセル | カービクティ |
一方、TCR-T細胞療法は、アメリカでは2024年8月に、成人の滑膜肉腫に対してアファミトレスゲン オートルーセル(TECELRA)が承認されました。がんに対するTCR-T細胞療法としては、初めての承認です。ただし、日本では未承認です。
ここではCAR-T細胞療法とTCR-T細胞療法を軸に、ゲノム編集技術を用いたがん治療について述べたいと思います(図1)。
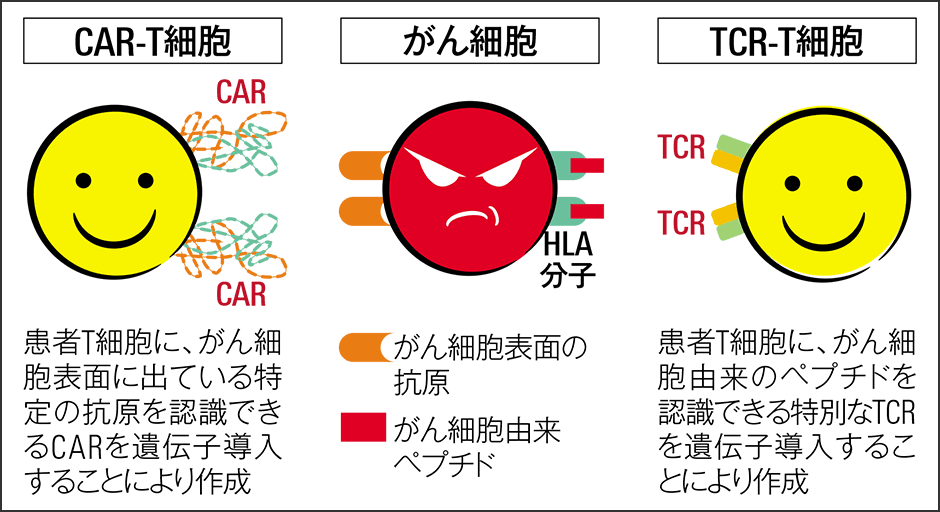
図1 CAR-T細胞とTCR-T細胞どちらも患者の免疫を強化してがん細胞を攻撃するが、標的が異なる。CAR-Tはがん細胞の表面にある抗原を、TCR-Tは患者のがん固有の抗原が標的だ。
治りにくい、あるいは再発しやすいがんを、難治性がんといいます。治るがんもあるのに、なぜ、難治性のがんがあるのでしょうか? はじめに、免疫とがんの攻防について触れておきましょう。
よく知られているように、私たちの体の中には、異物を見つけると、それを攻撃して取り除く免疫系というシステムがあります。免疫システムでは、リンパ球のT細胞やB細胞、NK(ナチュラルキラー)細胞といった免疫細胞が中心的な働きをします。とりわけリンパ球の中でもT細胞は、免疫細胞たちの司令塔のような重要な役割を持っています。胸腺(thymus)で作られるため、頭文字を取って T細胞と名づけられました。
T細胞表面にはTCR(T cell receptor:T細胞受容体)があり、外から入ってきた異物をヒト白血球抗原(HLA)を介して認識します。がん細胞は、さまざまな異常タンパクを作っており、がん細胞表面のHLA分子にはそれらが断片化されたもの(ペプチド)が提示されています。これらは、いわばがん細胞の目印(がん抗原)といえるでしょう。免疫細胞たちがこのがん抗原を見つけると、T細胞はTCRを使ってこれを排除すべき異物と認識し、がん細胞への攻撃が始まるという仕組みです。
ところが、がん細胞には目印であるがん抗原を隠したり、免疫システムによる異物発見や攻撃から逃れようとする性質があります。また、がんになると免疫抑制細胞が異常に増殖し、T細胞などの免疫細胞の働きを弱めることも分かっています。
がん細胞を認識する機能と攻撃する機能
一方の免疫システムには、過剰な免疫反応によって自分の正常な細胞が傷つけられないように、攻撃にブレーキがかかる仕組みも備わっています。がん細胞の中にはこれを悪用して、T細胞の攻撃にブレーキをかけるものもあるのです。
さて、現在までにがん細胞を免疫グロブリン(抗体)によって攻撃する抗体医薬品の開発技術が著しく発展しています。そこで、特定のがん細胞をTCRの代わりに「抗体」によって見分けさせようというアイデアが生まれました。そして抗体によってがん細胞を認識する機能と、そのがん細胞を攻撃する機能を合体させて、がんを認識すると攻撃のスイッチが入るようにした遺伝子を作成し、患者のT細胞に埋め込んで治療に用いる細胞医薬品(細胞を薬のように作り込んで患者に投与して疾患を治療する医薬品)が開発されました。それがCAR-T細胞です。CAR-Tは「カーティー」と読み、CARはキメラ抗原受容体を、TはT細胞を指しています。
異物を認識するアンテナであるTCRの本来の働きを活用し、特定のがん抗原を認識できるTCRを見つけ出し、それらを患者のT細胞に埋め込み直した「がん専門T細胞」を作って治療する方法もあります。それがTCR-T細胞療法です。実際、2006年、NCI(National Cancer Institute:アメリカ国立がん研究所)の Rosenbergらの研究グループは、メラノーマ(悪性黒色腫)患者に対するTCR-T細胞療法が有効であるという臨床試験結果を報告しました。
CAR-Tは特定のがんの細胞表面に共通して出ている抗原を認識することによって作用を発揮します。一方、TCR-Tでは、患者のがんに固有の抗原(ネオアンチゲン)を標的にすることが可能と考えられています。そうしたことから、TCR-T細胞療法は、特にネオアンチゲンの発現が多い固形がんに有効な新規治療法となることが期待されて、研究開発が進められています。
CAR-T細胞療法もTCR-T細胞療法も、患者一人ひとりの状態に応じたオーダーメード療法ともいえます。いずれも患者ごとに、次のようなプロセスを経て、治療を行うからです(図2)。
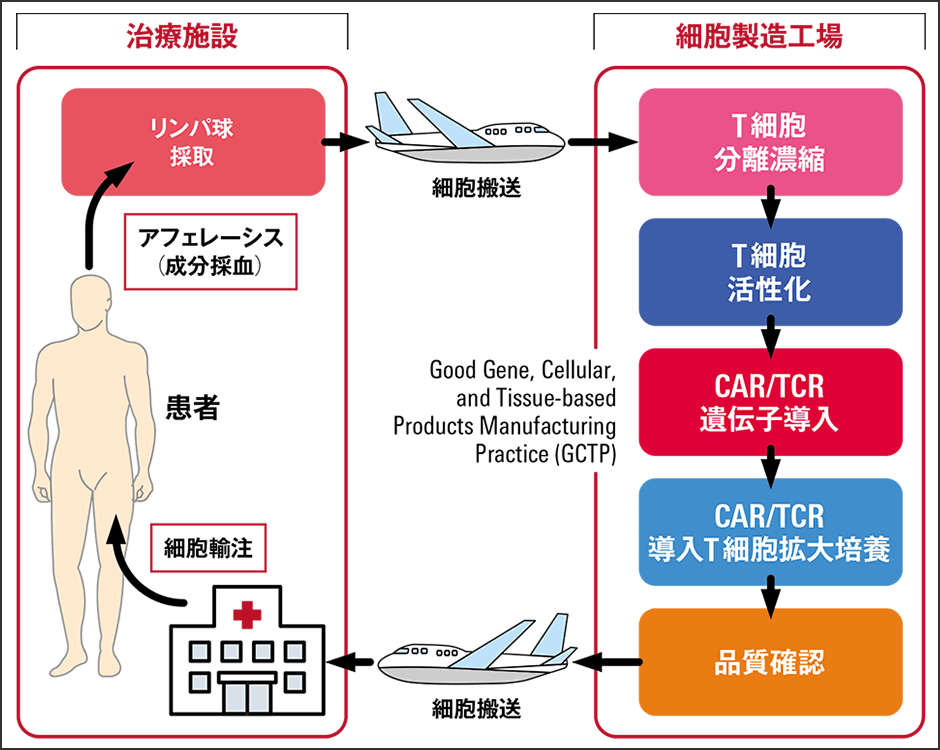
図2 遺伝子改変T細胞の製造工程CAR-T/TCR-Tいずれも、治療施設でリンパ球を採取し、細胞製造工場で遺伝子改変T細胞を作って、患者が待つ治療施設に送り返す。
〈1:患者からの成分採血〉
患者自身のリンパ球を採取し、細胞の製造施設に送ります。
〈2:CAR-T/TCR-T細胞製造〉
採取したリンパ球からT細胞の選別が行われます。CAR-T/TCR-Tを導入する遺伝子ベクターを作成し、遺伝子導入技術を使って前述のT細胞に入れて改変し、CAR-T/TCR-T細胞を作ります。拡大培養を行い、CAR-T/TCR-T細胞を十分な数まで増やします。
〈3:CAR-T/TCR-T細胞の投与〉
治療に入る前に患者側の準備としてリンパ球除去化学療法を行います。体内にあるリンパ球をあらかじめ減らしておくことで、投与されたCAR-T/TCR-T細胞を体内で増殖しやすくするのがその目的です。CAR-T/TCR-T細胞は点滴または注射により投与します。
投与後は、CAR-T/TCR-T細胞が、患者の体内で抗原を発現するがん細胞に結合して、攻撃を開始します。がん細胞への攻撃が奏功すれば寛解ということです。
世界初の第三者由来CAR-T細胞による治療
CAR-T細胞療法は、造血幹細胞移植などと比較すれば低侵襲の治療ですが、サイトカイン放出症候群や遅発性免疫不全など特有の副作用もあり、解決すべき課題もあります。日本の場合、国内に製造工場がないので海外輸送を含めて実際の投与開始まで時間がかかります。この間に患者の状態が悪化し、CAR-T細胞を投与できなくなる可能性もあります。
また、これは再生医療一般に言えることですが、患者から採取した細胞から作るので、その効果には個人差が生じます。難治性がんの場合、患者由来の細胞はそれまでの治療で疲弊しているケースが少なくありません。T細胞が弱っていると、最悪の場合、CAR-T細胞が製造できない場合も起こり得ます。
こうした課題を解決する方法として考えられたのが、第三者由来の改変T細胞です。あらかじめ健康なドナーから提供を受けたリンパ球でCAR-T細胞を作成して凍結保存しておけば、治療が必要になった時点ですぐに使えるようになるだろうという発想です。こうして2015年、ロンドン大学において、ゲノム編集を施した細胞として世界で初めて作られた第三者由来のCAR-T細胞が2人の白血病の小児患者に用いられました。
なぜ、ゲノム編集が必要だったのでしょうか? T細胞は、TCRを介して自分と他人を見分ける機能を持っています。他人(ドナー)のT細胞をそのまま患者に投与してしまうと、ドナー由来の改変T細胞に発現するTCRが患者の正常臓器を攻撃してしまいます。これをGVHD(graft versus host disease:移植片対宿主病)と呼びます。
患者の体内でこういう有害な反応が起こることを回避するために、第三者由来のCAR-T細胞を作るにあたっては、ドナーのTCRの遺伝子をノックアウトしなければなりません。そこでゲノム編集のハサミで切り取って、GVHDが起こらない状態にするというわけです。
世界初の第三者由来のCAR-T細胞による治療は成功し、白血病のがん細胞を減らすことができました。当時はCAR-T細胞療法だけで寛解するかどうかは不明だったので、その後2人とも健常なドナーからの造血幹細胞移植を受けて完治しました。この報告を受けて、世界中で第三者由来のCAR-T細胞を作ろうという研究が盛んになりました。
患者自己由来のCAR-T細胞として初めて承認されたチサゲンレクルユーセルの薬価は、現在、日本では保険収載当初より安い約3265万円に改定されています。今のところゲノム編集で作った第三者由来のCAR-T細胞は上市されていないので、どのような価格になるのか分かりません。上市された場合の薬価がどのくらいになるのか、大変気になるところです。
CAR-T細胞療法もTCR-T細胞療法も、安全性を高め、より良い効果を発揮するようにと、国内外で開発研究が進行中です。特に日本では、国産技術を活用した国産の新規T細胞医薬品の開発が待望されています。
なぜなら、これまで述べたように、CAR-T細胞療法は、国内に製造拠点がなく、国産の製造技術も少ないため、海外往復輸送や海外ライセンス技術の利用に時間も経費も要します。国産の技術を使って国内で製造できれば、経費と時間を圧縮できるでしょう。それは、治療のスピードアップだけではなく、薬価の抑制にもつながると期待できます。
また、改定されたとはいえ、CAR-T細胞医薬品の薬価はいずれも3200万円超です。患者側の負担は、高額療養費制度などもあるので、年齢や収入などによって異なります。適用条件が限定されているので、他の疾患と比べて患者数が少ないことから、保険財政を圧迫する事態には至っていません。しかし、共に支え合う国民皆保険制度の財政維持のためにも、超高額の薬価の抑制は社会的な課題ともいえるのではないでしょうか。
日本独自の技術開発とライセンスを目指して
私たち広島大学は、TCR-T細胞療法の開発に取り組んできました。広島大学で開発されたゲノム編集ツールであるプラチナTALENを用いて、NY-ESO-1をがん抗原とする、安全性と有効性に優れたTCR-T細胞療法の開発を目指したのです(図3)。
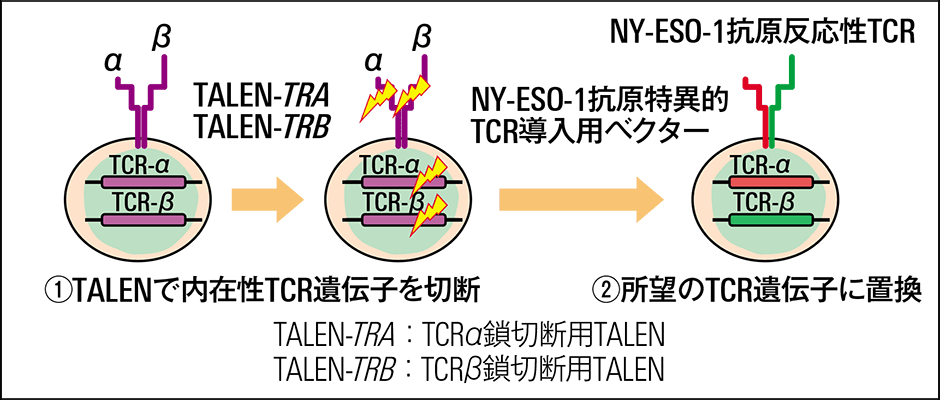
図3 NY-ESO-1抗原特異的ゲノム編集T細胞の製造NY-ESO-1を標的として攻撃力を強化した改変遺伝子カセットを作出し、的確に患者のTCR遺伝子に置き換える。
がん抗原として使用するNY-ESO-1は、正常組織では精巣にのみ発現が限られるとされています。しかし、食道がん、肺がん、乳がん、卵巣がん、前立腺がん、膀胱がん、メラノーマなど、多くの固形がんや一部の血液がんで発現が認められています。
さまざまながん治療への応用が期待できる一方で、TCR-T細胞療法には内在性TCRの干渉という課題が指摘されていました。患者がもともと体内に持っているTCR(内在性TCR)と遺伝子導入されたTCRとの競合が起こると、両者が互い違いに結合するミスペアリングが生じる可能性があるということです。
そこで私たちはこれを回避するために、プラチナTALENによるゲノム編集技術を用いてあらかじめ患者のTCR遺伝子を非機能化しておき、その後にがん抗原特異的なTCRの遺伝子を導入するようにしました。
また、従来のCAR-TおよびTCR-Tは、T細胞に遺伝子を導入する際にウイルスベクターを用いていました。しかしこの方法では、遺伝子がゲノム上にランダムに導入されてしまうという問題があります。確率は低いものの、予期せぬ場所にベクターが導入されると発がん遺伝子の活性化などの有害な変異が起こる可能性があります。そのため、私たちはTCR遺伝子の部位に正確にNY- ESO-1 抗原特異的TCR導入用ベクターを導入する技術の確立も開発テーマに含めていました。
すべての技術を用いて、NY-ESO-1を認識するゲノム編集型TCR-Tをヒト細胞加工医薬品として製造する基盤技術を確立するとともに、ゲノム編集を用いて作出した細胞医薬品の安全性を保証するための技術開発も目指していました。簡略して言うと、ゲノム編集技術を用いて内在性TCRの干渉を起こさない遺伝子改変カセットを作成し、患者のTCR遺伝子にピタッと収まるT細胞医薬品の創薬を目指していたのです。
しかし、日本医療研究開発機構(AMED)による2019年採択の医療研究開発革新基盤創成事業(CiCLE)として進行していたこのプロジェクトは、残念ながら、2024年に開発研究中止という決定に至りました。
創薬にはさまざまな技術が不可欠です。それらの権利はライセンスで守られています。それが薬価に反映されて高額になっていることも否めません。研究に立ちはだかったのは、海外ライセンスの壁でした。その金額は私たちの予想をはるかに超えるもので、円安という逆風も重なり、断念せざるを得ませんでした。良い成果が出ていただけに、本当に断腸の思いです。
ゲノム編集技術は間違いなく次世代医療開発の鍵となっていくことでしょう。そうして生まれた治療方法や薬剤を、保険財政を圧迫することなく、患者が安心して使えるようにするためには、海外知財に頼らない日本独自の新基盤技術の開発とその技術のライセンスを保護する国家的レベルでの知財戦略が必要ではないかと痛感しています。