バクテリオファージは細菌に感染するウイルスのことで、感染したほとんどの細菌は死滅するといういわば細菌の天敵だ。この作用を利用して感染症の治療をするファージ療法は、かつて盛んに行われていた。しかし抗生剤の発見により、ファージ療法はやがて、いわば忘れられた存在となっていく。しかし近年、どんな抗生剤も全く効かない多剤耐性菌の出現で、ファージ療法が再び注目されている——。
特集 知られざるウイルス 多剤耐性菌の出現で注目の「天敵」バクテリオファージ
構成/飯塚りえ
細菌に感染するウイルス「バクテリオファージ(以下、ファージ)」は、1915年にすでに知られています(図1)。感染された細菌は細胞膜が破壊され、食べ尽くされるかのように死滅(溶菌)するため、「細菌(bacteria)を食べるもの(ギリシア語でphagos)」という意味の名がつけられました。
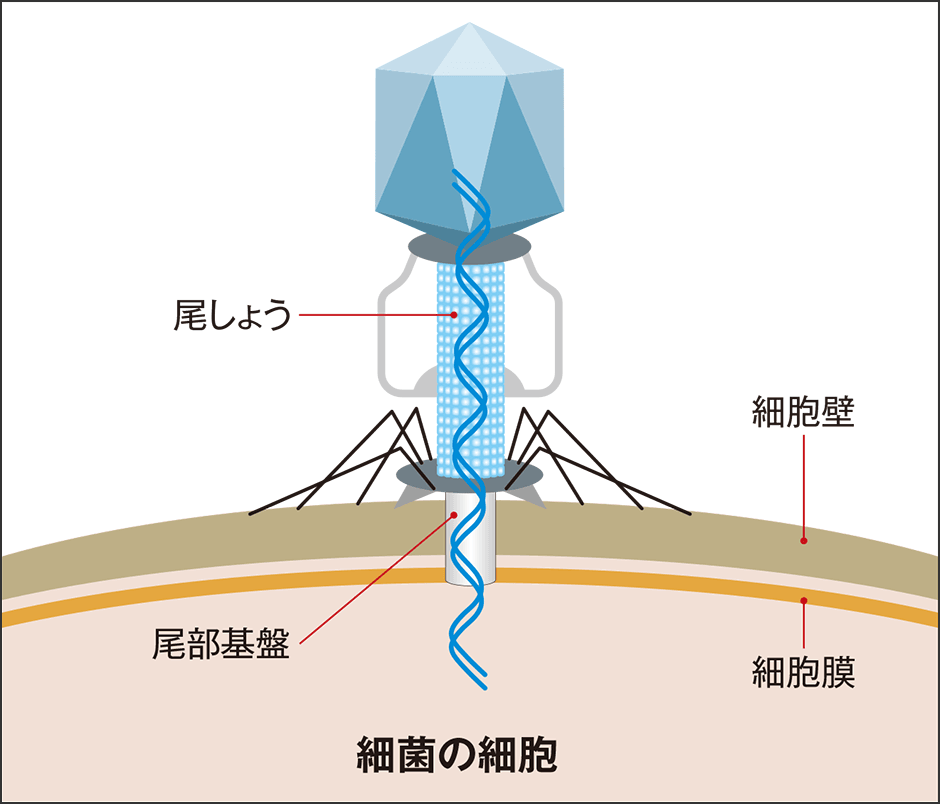
図1 ファージの感染ファージは環境中にも多く存在し、取りついた細菌に核酸を注入する。核酸は細菌内で複製され、最終的には食い破って外に出る。
がんに迫る多剤耐性菌による死亡者数
ファージが見つかった20世期の初頭は、灌漑治水が整っておらず、細菌性の下痢症などの死亡率も高い時代でした。その治療にファージが活用されていたのですが、1928年、ペニシリンの発見によって西側諸国ではファージはすっかり廃れてしまい、以降、西側では抗生剤の天下となりました。ところが冷戦時代、東側諸国では西側で新規に開発された抗生剤が手に入らない時期が続き、彼の地では抗生剤ではなくファージがさまざまな産業で展開されることとなりました。
例えば、果物や野菜を腐敗させる菌を殺すファージをまいておくといった食品添加物のような使い方です。市場で切り売りしている肉や魚などにも使われていますし、日本での乳酸菌製剤等の整腸剤の位置づけで、いくつかのファージをカクテルした薬剤も販売されています。他にもファージによるニキビ治療薬や医療施設の床の消毒剤などもあります(図2)。

図2 ロシアで市販されるファージ薬医師の処方箋が必要なものから街の薬局で手軽に買えるものまで、ロシアではファージ薬が広く利用されている。
加えて、抗生剤の世界的な濫用によって、冷戦後は東側でも多剤耐性菌がどんどん出てきてしまいました。もはや多剤耐性菌は西側だけの問題ではなく、世界保健機関(WHO)は、2050年には多剤耐性菌による死亡者数が世界で年間1000万人を超えると試算しています。がんを抜く死亡原因となるということです。
世界がファージに注目するきっかけとなったのが「パターソン症例」です。2016年、アメリカ・カリフォルニア大学サンディエゴ校のトム・パターソン氏は、エジプト旅行中に多剤耐性アシネトバクター肺炎にかかってしまったのですが、既存の抗生剤が全く効かず生死の境をさまよいました。
大学の同僚でもあったパターソン夫人はファージ療法を探し出し、試すこととなりましたが、ファージは、基本的にAというファージがBという細菌を殺す、というように1対1対応で、ファージならどんな細菌をも殺すということはありません。まずパターソン氏の菌を溶菌するファージをスクリーニングすることから始め、他国の研究施設やアメリカ軍の所有するストックから効果のあるファージをようやく見つけ出し、それらが著効してパターソン氏は生還したというわけです。
世界中の研究機関がファージに注目
この一件がエポックメイキングな症例となって、世界中の研究機関がファージに注目するようになりました。パターソン症例後、程なく、英国ロンドンの病院では白血病で重度の免疫不全の患者が多剤耐性非定型抗酸菌に感染し、こちらは遺伝子改変ファージで治療が行われましたし、細菌感染症だけでなく、特定の腸内細菌をファージで溶菌してアルコール性肝疾患の治療ができることがマウスで解明されるなど、ファージを利用した新しい治療に期待がかかっています。
日本でもファージ療法の研究が広がりつつありますが、私は腸管免疫の研究を進める中で、特定の腸内細菌が引き起こす疾病について、ファージによる治療を目指しました。
まずは腸内細菌ファージの探索から始める必要がありました。腸内には、細菌に感染して共生しているファージも常に存在します。ところが、この研究に着手した頃は、嫌気性の腸内細菌を培養すること自体が難しく、それに感染するファージを分離するというのは不可能に近い作業でした。
2015年ごろでも、次世代シーケンサーでファージらしき配列を認められてもデータベースで「unknown(未知)」とされる状態だったので、腸内ファージは「Viral Dark Matter(ウイルスの暗黒物質)」と呼ばれるほどでした。私たちは、腸内ファージの探索を進めるために、便からファージのゲノム、DNAを採取する手法を確立することに成功しました。それらを次世代シーケンス解析によってファージゲノムの断片を網羅的に取得して、スーパーコンピュータを用いて元のファージの塩基配列に復元し、さらにその遺伝子領域を決定してコンピュータ上でウイルスをクローニング、それによって分類を可能にするというパイプライン(コンピュータなどで、ある要素の出力が次の要素の入力となるようにして、並行に処理させる一連の処理方式)を作るまでに至りました。
これを用いて2020年に日本人健常者101人の腸内細菌と腸内ファージのデータベースを公開しました(図3)。同じ便のサンプルから腸内細菌叢と腸内ファージ叢を同時に分類したのは、世界で初めてです。この結果では、腸内ファージ叢が3パターンほどに分かれているということがわかりました。
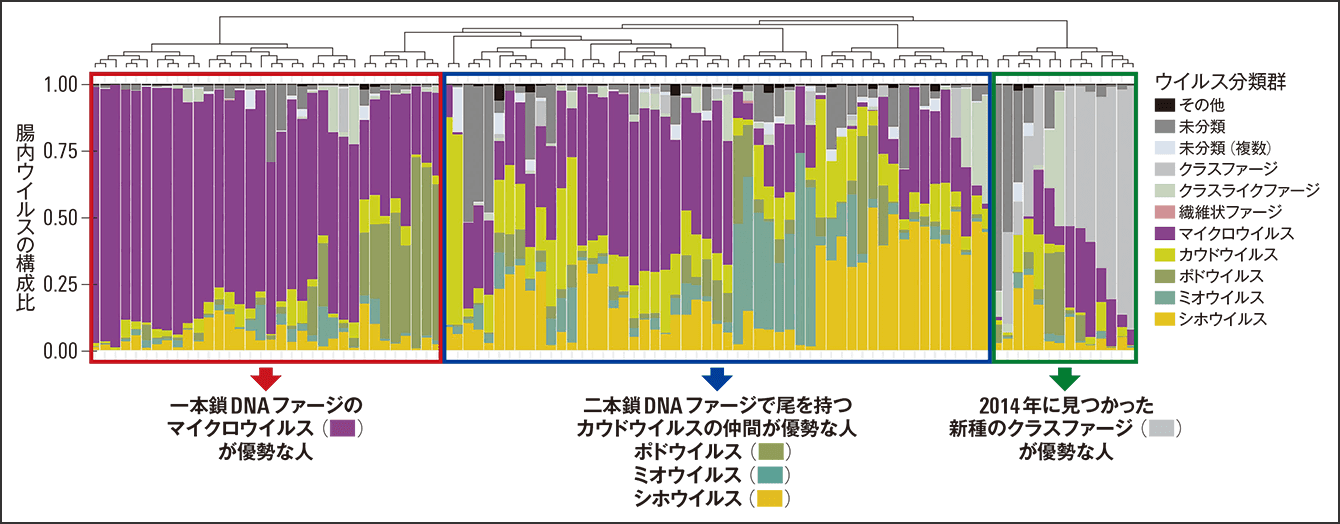
図3 日本人健常者の腸内ファージ叢の構成優位性によって、一本鎖DNAゲノムを持つマイクロウイルスが多い群、尾部のあるカウドウイルス(ポドウイルス、ミオウイルス、シホウイルスなど)が多い群、そしてクラスファージ(crAss phages)の多い群と3つに分かれる。クラスファージは2014年に新種のファージとして単離された。ヒトだけでなく家畜やげっ歯類、環境中などで、クラスファージと同様の構造、機能を持つファミリー(科)が多く見つかっている。
個人の体調などによって変化があるものの、腸内細菌叢に比べて腸内ファージ叢は、種の変化が少なく優勢なファージ群が固定されている印象がありました。まだファージのパターンと疾病の相関関係は解明できていません。しかし、Zという細菌に感染できるファージがα、βなど複数いて、Aさんの腸内にはαファージが多いとしたら、それはαファージとβファージがZ細菌という宿主を取り合い、Aさんの腸内環境ではαファージが勝ったという状況を意味します。恐らく、母親から受け継いだものや環境要因などで決まると考えられます。今後、研究を進めたい部分です。
どの腸内細菌が感染しているかが見える
同時に、「ファージと細菌の感染対応表」を作成すべく2つの手法を構築しました。一つは、ゲノム編集で注目される細菌のCRISPR-Casシステムという免疫機構を応用したものです。
細菌は、初めてファージに感染されると、Casという酵素が、そのファージの特徴的で変化しにくい重要な配列をかじり取って、自身のCRISPRの遺伝子座(スペーサー)に取り込みます。この部分はつまり、細菌の過去の感染履歴といえるのです。そうであれば、この部分と、データベース化されているファージとを引き比べることで、「取り込まれているファージの配列はシホウイルス由来」などとわかります。
そこでシホウイルスに対するスペーサーを持っているのはどのような菌かを検索すれば、どの腸内細菌がシホウイルスに感染しているかが見えるようになります。これまでに腸内細菌叢の中でも最優勢菌の一つであるバクテロイデスが、近年発見されたクラスファージ由来の特徴的なスペーサー配列を持っており、少なくともクラスファージはバクテロイデスに感染したことがあるとわかりました。
もう一つの検索方法は、ファージの感染形態に由来しています。ファージには、細菌に感染する際、完全に細菌を殺してしまう溶菌性と、宿主細菌の環状染色体にゲノムが挿入されて組み込まれ、細菌と共生していく溶原性との2種類があります(図4)。組み込まれた部分をプロファージと呼び、この部分を腸内細菌ゲノムデータベースと相同解析すれば、プロファージを取り込んだ細菌がわかるのです。私たちは、バクテロイデス・ユニフォルミス菌に100%マッチする配列を検索したのをはじめ、溶原化するファージは一網打尽で検索できるようになりました。こうして、どのようなファージがどの菌に感染するかをデータベースにまとめることができたのです。
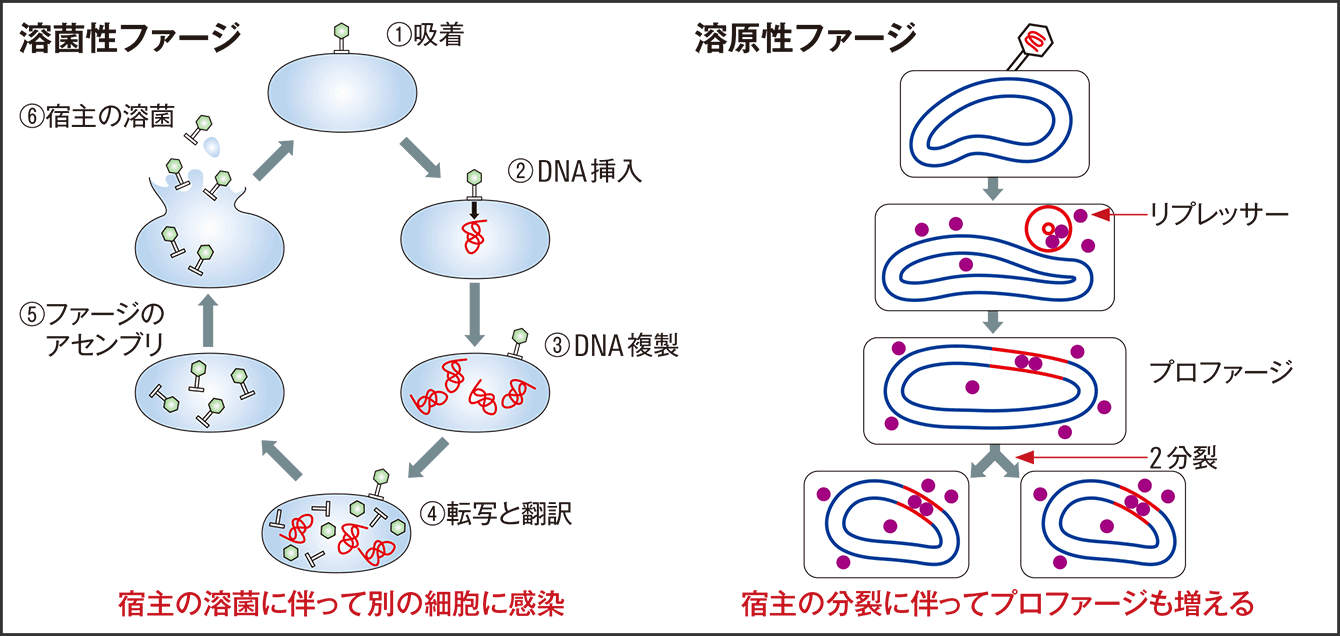
図4 溶菌性ファージと溶原性ファージ溶菌性ファージは細胞を破壊して次の細胞に感染する。溶原性ファージは感染した細胞に取り込まれ、細胞の分裂に伴って増える。
この成果を、治療に生かすべく、まず偽膜性腸炎の治療の研究を進めています。
偽膜性腸炎は、抗生剤の投与によって腸内細菌のバランスが崩れ、平常時には少ないクロストリディオイデス・ディフィシル菌が増殖して毒素を出し、腸炎を起こすものです。日本国内の例では、最初に使った抗生剤を中止すると、腸内の常在菌が復活して駆逐されることがほとんどですが、海外では第3の毒素と呼ばれるバイナリートキシンを持つ強毒株が見つかっています。この株は多剤耐性で、重度の偽膜性腸炎になって死亡する例が多くあります。
ところがディフィシル菌は、ファージが感染しにくいという特性があり、溶菌性ファージも見つかっていません。そこで私たちは、ファージの持つ酵素に注目しました。
注目されているファージ由来の酵素
ファージの持つ酵素の中でもよく知られているのが、エンドライシンと呼ばれるタンパク質です。細菌内でファージが産生して細菌の細胞膜のペプチドグリカン層を開裂して破壊するのですが、グラム陽性菌の細菌の場合、ペプチドグリカン層が露出しているので、この酵素を細菌の外から振りかけることでも細胞膜を破壊することができます。抗生剤の使用を控えたい乳牛の乳房炎治療に適しているのではないかなど、いろいろな分野で注目されているファージ由来の酵素ですが、ディフィシル菌は都合のよいことにグラム陽性菌ですから、この酵素が利用できると考えました。
健常者の腸内細菌叢に含まれるディフィシル菌のゲノムと、偽膜性腸炎を発症した患者から単離したディフィシル菌のゲノムデータをそれぞれ解析して、ディフィシル菌にプロファージとして取り込まれている溶原性のファージをいくつも見つけることができました。ここからディフィシル菌を溶菌できるエンドライシンの酵素のゲノムを探索したところ、10種類ほどが見つかったのです。この配列に従ってタンパク質合成を行い実験したところ、いくつかの酵素はディフィシル菌を非常によく制御することがわかりました。
プロファージを作る溶原性ファージは細菌間で伝播することが知られています。例えば、O157のベロ毒素は赤痢菌が作るシガ毒素に遺伝的に酷似しており、同じ溶原性ファージによって伝播したとされています。そのため、溶原性ファージ由来のファージを療法に利用することは禁忌とされていたのですが、ファージではなくその酵素に着目し、酵素部分だけを合成することで、新しい治療の可能性が開かれるのではないかと考えています。
抗生剤と同様に、菌がファージに耐性を持つようになることも当然、想定されています。それに対抗するためにファージ療法の方法も、1種類のファージを単体で使うのではなく、いくつかを混ぜて使うカクテル療法が推奨されます。また用途も感染症に関わる細菌だけでなく、ファージの宿主特異性から特定の腸内細菌をピンポイントで制御して有用菌に影響を与えない方法も期待されます。
さらに、ファージの遺伝子を改変する改変ファージ技術、ファージの産生する溶菌酵素を合成し抗生剤として用いる次世代ファージ療法など、さまざまな治療法を模索しています。
日本では、実用化までのハードルが高いものもありますが、他方、コロナ禍が一段落し、以前のように海外との交流が盛んになれば、今、日本では大きな問題になっていない多剤耐性菌が一気に押し寄せてくる可能性は否めません。そのときに備えるべくファージ療法の選択肢を一つでも多くそろえたいと考えています。多剤耐性菌の制圧や、腸内細菌制御による新しい治療法の創出など、ファージ未来医療を実現したいと思います。