クラゲやホタルなど光を発する生物は、独自の発光メカニズムを持っている。最初に発見されたのは、オワンクラゲの光るタンパク質。その後、この蛍光タンパク質を応用した生体蛍光イメージングが開発され、細胞や組織を「生きたままリアルタイム」で観察できるようになった。結果、生命科学研究は大きく発展。今では、それぞれの生物が持つ発光メカニズムを生かしたイメージングが生み出され、精度の高い「視覚化」が可能に。がん細胞の動態解析など多方面に貢献している。
特集 進化する「視覚化」 発光生物のメカニズムを応用する「リアルタイム」での観察
構成/大内ゆみ
地球上には、クラゲやホタルなど、光る生物が存在します。その発光の仕組みを解明する研究を行っていた下村脩博士が、オワンクラゲから緑色蛍光タンパク質(GFP)を発見し、論文発表したのは1962年のこと。それから数十年を経て、マーティン・チャルフィー博士が線虫の細胞にGFP遺伝子を組み込み、オワンクラゲ以外でGFPを発現させ、生体の細胞を光らせることに成功しました。
さらにロジャー・Y ・チェン博士がGFPの変異体を作製して、緑色以外のさまざまな色の蛍光タンパク質を開発しました。これらの研究成果が礎となり、蛍光を「目印」にして(蛍光標識)、細胞や組織を生きたままリアルタイムで観察できるようになったのです。この技術は「生体蛍光イメージング」と呼ばれ、生命科学研究の発展に大きく貢献しました。3人の研究者の偉業は、2008年ノーベル化学賞の受賞に至っています。
蛍光物質とは異なる仕組みで光る生物も
そもそも蛍光という現象はどのようにして起こるのでしょうか。通常、分子に光を当てると、そのエネルギーをためこみ(光の吸収)、瞬時に熱、振動や光などでエネルギーを放出して、元の安定したエネルギー状態に戻ろうとします。このエネルギーの放出において、蛍光タンパク質は蛍光を発しやすいために光るのです。そのため、生体蛍光イメージングでは光を照射して試料が発する蛍光を観察する蛍光顕微鏡が必要です。
実は、光を吸収して蛍光を発する物質、いわゆる蛍光物質は、タンパク質以外にも多く存在しています。身近なところでは、蛍光色の入浴剤に含まれるフルオレセインなどの蛍光有機小分子があり、さらに、薬剤の中にも肝機能検査に使われるインドシアニングリーン(ICG)や抗がん剤のアドリアマイシンなど光る物質があります。こうした物質も蛍光色素として生体に用いることができ、蛍光タンパク質にはないメリットもあります。というのも、蛍光タンパク質はその遺伝子を生体の細胞の中に組み込む必要があり、ヒトには使うことができません。しかし、蛍光色素であれば、ヒトの体に注入してリアルタイムな観察ができます。すでに眼科領域では、フルオレセインとICGを用いた蛍光眼底造影検査、外科領域ではICGを用いた切除範囲の決定やリンパ管造影検査など、臨床応用が進みつつあります。
蛍光物質とは異なる仕組みで光る生物もいます。例えば、ホタルは蛍の漢字を持つものの、蛍光タンパク質によって発光しているわけではありません。この光は、ホタルが持つ酵素のルシフェラーゼと発光物質ルシフェリンの化学反応によって光ります。光を当てなくても発光するため、暗い所で高感度カメラを用いた撮影による可視化が可能で、この反応を利用した生物発光イメージングも生体観察に有用なツールになっています。
私たちの研究室では、それぞれのイメージング技術の特性を生かしながら、基礎医学研究や医療応用研究を行っています。中でも長年にわたり研究しているのが、がんの分野です。私自身、がんの研究者で、かつては取り出してきたがん細胞や組織をすりつぶしたり、固めたりして、がんを観察していました。しかし、それでは生体内のがんの動きを見ることができず、同じ個体で経過を観察することもできません。当時から、体の中でがんが実際にどう働いているかというのが最も関心のあるところで、このイメージングの研究を始めたきっかけでした。
がん細胞の動態を詳細に解析できる
特にがんで問題なのが転移です。いまや局所にとどまるがんであれば、外科手術で取り除くことが可能ですが、転移がんはいまだ治療が困難です。そのため、転移のメカニズムの解明が重要だと考えています。
がんの転移には、がん細胞が血液の流れに乗って移動する血行性転移があります。そこで、蛍光タンパク質の遺伝子を組み込んだヒトのがん細胞をマウスの血管内に移植した実験を行いました。すると、がん細胞が血管内を移動し、血管壁から血管外に脱出する様子が観察されました(図1)。このようにマクロの世界からミクロの世界へとズームインできるのが、生体蛍光イメージングの大きなポイントで、さまざまながん細胞の動態を詳細に解析することが可能です。
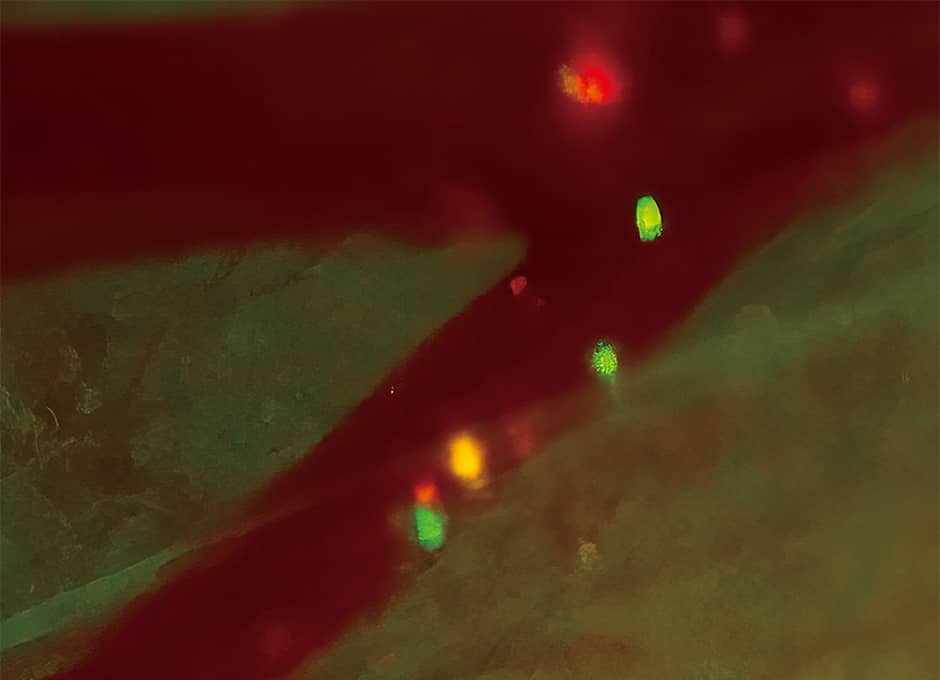
図1 がん細胞の血管内の移動蛍光タンパク質を発現するがん細胞が血管内を移動している様子。緑色の光ががん細胞。(スキンフラップ法という手法を用いた実験)
また、がんは新しい血管を形成して、その血流に乗り、全身に転移していきます。その血管新生の様子とがん細胞の動態も、生体蛍光イメージングと生物発光イメージングを組み合わせた実験で確認しています。これは、抗がん剤の一種である血管新生阻害薬を評価するツールとして活用されています。
加えて、がんではリンパ管を介したリンパ節への転移があります。蛍光タンパク質を発現させたがん細胞を移植したマウスに、異なる種類の蛍光色素をリンパ管や血管に入れると、それぞれ違う色で細胞と管を描出することができます。そのため、がんが転移する過程において、血管とリンパ管やリンパ節がどう関わっているかを同時に観察することができます。
がんによっては転移しやすい部位が分かっているものがあり、乳がんは骨、大腸がんは肝臓などに転移が多いとされています。実際に、ヒト乳がん細胞にルシフェラーゼ遺伝子を導入し、その細胞をマウスの心臓に注射して、ルシフェリンを投与後に転移の過程を生物発光イメージングで観察しました。すると、注射直後では体全体に青白く光るがん細胞が存在していましたが、1週間でほとんど見えなくなりました。これはなぜかというと、がん細胞は安定した足場がないと細胞死を起こしてしまうからです。しかし、3週間後、骨に増殖するがん細胞が確認され、視覚的にも乳がんには骨転移の指向性があることが実証されました(図2)。
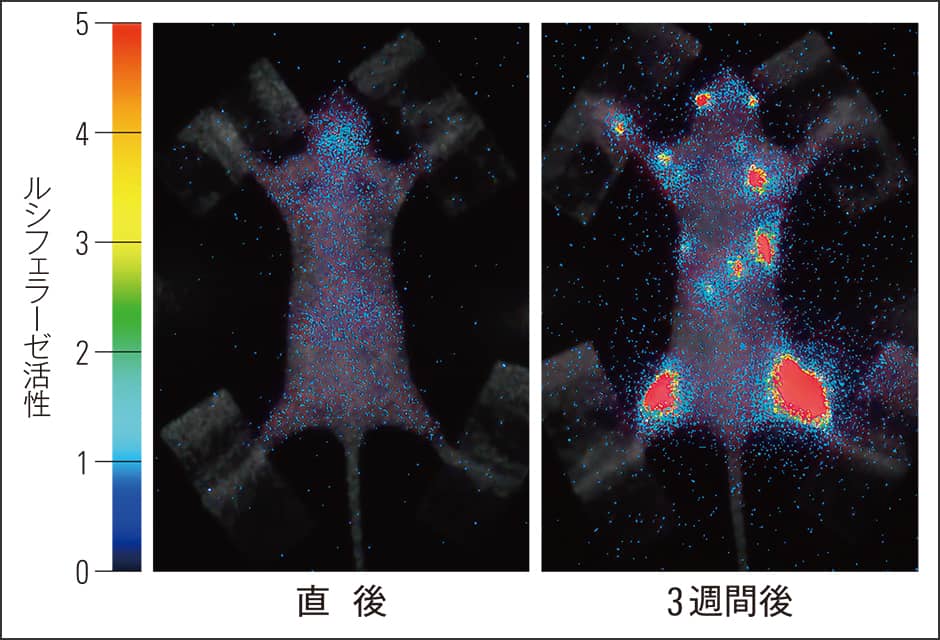
図2 がんの骨転移骨転移モデルにおける生物発光イメージング。光っている所ががん細胞で、3週間後に骨に転移していることが分かる。光が青~赤色になるほど、がん細胞が多いことを示す。
このように、生物発光イメージングは、感度が高く、全体像で大まかな変化を捉えられるのがメリットです。一方で、生体蛍光イメージングは前述したように細かな所にフォーカスできるメリットに加え、さらに遺伝子改変により蛍光タンパク質を工夫することで、さまざまな細胞機能を見ることができます。
細胞内部の現象も捉えられる
例えば、理化学研究所の宮脇敦史氏が開発した「Fucci(フーチ)」は、細胞が分裂して増える状況を段階的に可視化できるシステムです。具体的には、赤と緑の2色の蛍光タンパク質の遺伝子を、細胞周期の特定の時期に存在する2種類のタンパク質の遺伝子に結合させ、その2種類の遺伝子を細胞に導入すると、細胞周期のG1期またはG0期の細胞核は赤色、S/G2/M期の細胞核は緑色と、色を分けて観察することが可能です。G1期は細胞が増えていない時期で、G0期はいわば冬眠状態です。S期はDNAの複製期、G2期は細胞分裂の準備期、M期は細胞分裂の段階です。
私たちは宮脇敦史氏との共同研究で、正常に近い培養細胞(正常細胞)とヒトのがん由来の培養細胞(がん細胞)にFucciを導入し、シャーレの上で培養して、両者の違いを調べてみました。すると正常細胞は、ある程度細胞が増えるとそれ以上増えずに、すべての細胞の核が赤色(G1期またはG0期)になりました。これは細胞がシャーレの上ですし詰め状態になると細胞増殖の接触阻害が起き、過剰に増殖することを制御しているためです。ところが、がん細胞はスペースがなくなっても積み重なるようにして、無秩序に増えていきます。この異常増殖ががんのがんたるゆえんでもあります。Fucciを使えば、その増殖の様子に加えて、細胞が増殖停止・冬眠状態なのか活動期なのかが分かるのです(図3)。
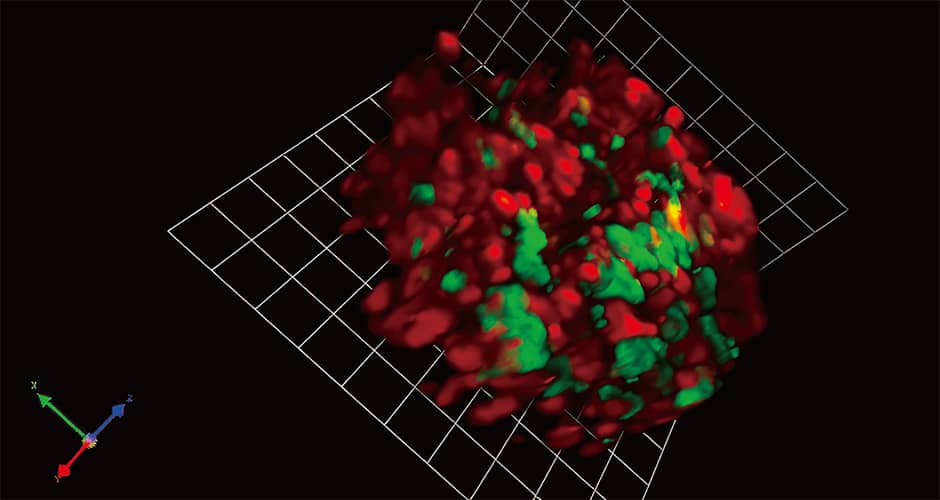
図3 Fucciによる3D蛍光イメージング骨に転移した乳がん細胞。赤色はG1期またはG0期(増えていない)、緑色はS/G2/M期(分裂している)を示す。蛍光タンパク質を遺伝子改変することで、これまでは分からなかった情報を目で確認できる。
さらに私たちは、Fucciを組み込んだがん細胞をマウスに移植し、骨転移を起こさせました。すると、骨転移の病巣では、初期はG1期またはG0期の細胞がほとんどを占め、末期にはG1期またはG0期と活動期の細胞が混在していました。そこで、殺細胞性の抗がん剤を投与したところ、G1期またはG0期の細胞のみが生き延びたのです。殺細胞性抗がん剤の作用は、細胞の分裂や増殖の阻害であるため、当然の結果だといえますが、活動期以外の時期に投与しても効果がないことが目に見えて明らかになったのです。
それに加え、がんの再発には冬眠状態のがん細胞が関与していることが考えられます。このことから、治療においてはG1期またはG0期のがん細胞へのアプローチが重要だということが分かりました。つまり、冬眠状態のまま起こさないか、冬眠から目覚めさせ抗がん剤や放射線療法でたたくか、どちらかが考えられるのです。現在、Fucciを用いて、冬眠から覚めるきっかけを明らかにする研究も進めているところです。
また、岡山大学との共同研究では、がん細胞が上皮間葉形質転換(EMT)を生じたときに赤色に発光する蛍光タンパク質を開発しました。EMTはがんの転移過程の一つで、簡単にいうと、きれいに整列した上皮細胞が、足のような突起を持った間葉系細胞に形質転換して、移動できるようになる現象です。このように従来では見えなかった細胞内部の現象も生体蛍光イメージングで捉えることができるようになったのです。EMTはがんの治療抵抗性の原因の一つと考えられており、このイメージングによって、がんの薬剤耐性のメカニズムの解明やその阻害剤の開発が進んでいます。
以上のように、生体蛍光や生物発光イメージングはがんのメカニズムの解明、治療薬の有効性の評価や新たな治療の開発に有用なツールです。さらに将来的な展望として、がんの手術にも光を使った技術が応用されることが考えられます。すでに現在、組織を切除することなく、がんを診断できる光生検の開発が進んでいます。また一部のがんでは、がん細胞に光に反応する物質を付け、レーザー光を当ててがんを消滅させる光免疫療法など光線力学的療法が保険適用になっています。
例えば、マルチカラーで血管や組織を光らせて術野をナビゲーションし、光生検で腫瘍が悪性であれば、その範囲を光で確認しながら切除します。取り切れなかったがんを光線力学的療法で切除すれば、がんを一網打尽にできるというわけです。光は放射線と違い、体にとって負担が少ないのもメリットです。
顕微鏡やデジタル画像処理システムも重要
細胞や組織を光らせる技術だけではなく、それを観察するための顕微鏡やデジタル画像処理のシステムも非常に重要です。私たちの研究室には、理工学や数理物理学出身のメンバーが所属していて、光学機器メーカーと協力し新たな顕微鏡の開発にも取り組んできました。
その一つが、2光子励起顕微鏡という蛍光顕微鏡で、従来の蛍光顕微鏡では見えなかった深部組織を見ることができます。例えば、マウスの脳の神経細胞を生体蛍光イメージングで観察するときに、これまでの顕微鏡では大脳新皮質の数百ミクロンの深さのほぼ表面しか見えなかったものが、2光子励起顕微鏡を使えば錐体細胞の細胞体まで見ることができます。さらに私たちが開発した新しいレーザーを搭載した特殊な2光子励起顕微鏡を使えば、さらに海馬の細胞まで見ることが可能です(図4)。しかも、2光子励起現象を光シート顕微鏡という特殊な顕微鏡に応用すると、3次元の画像を高速、かつ長時間撮影できるため、いわば4次元の細胞観察が可能です。この顕微鏡を使って、メダカの胚発生過程を3日間にわたり全身を細胞レベルで生きたまま撮影することにも成功しました。
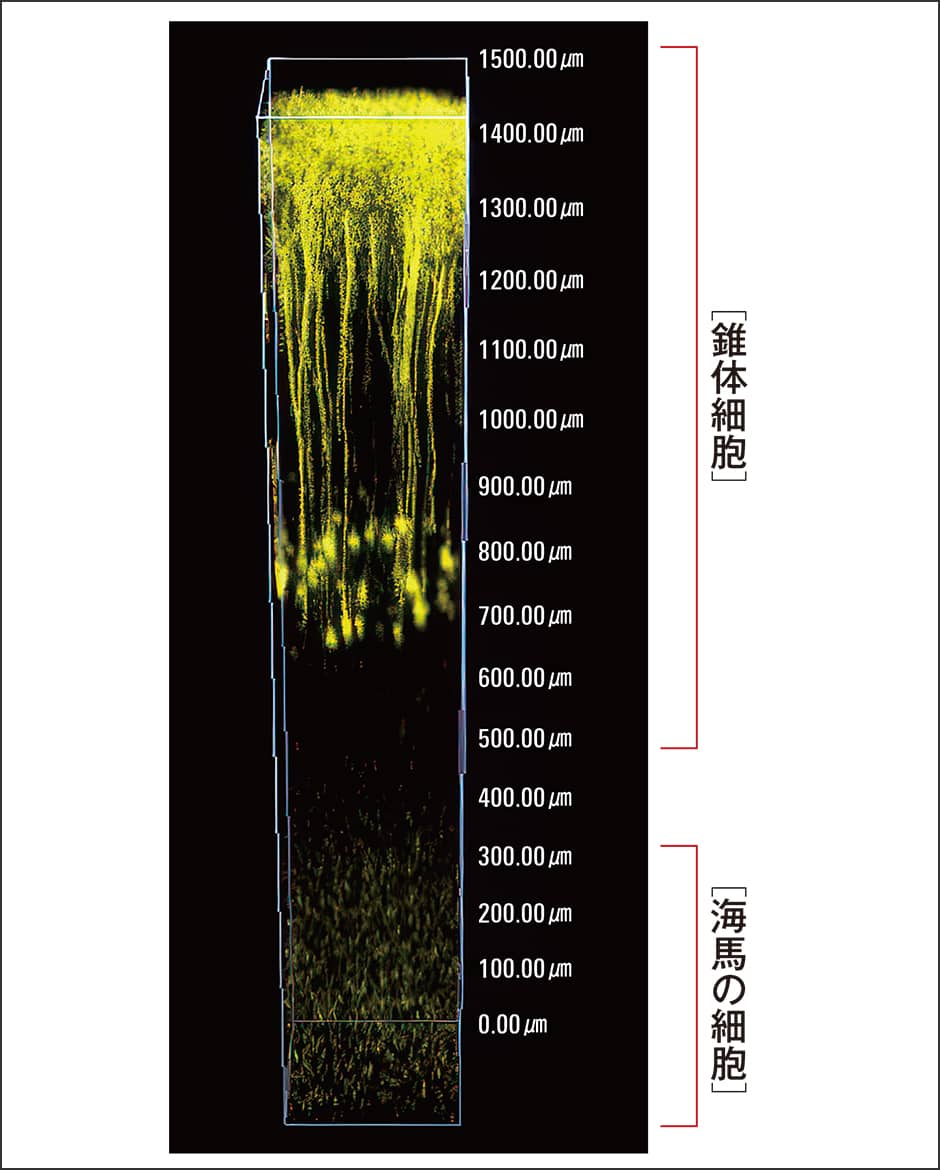
図4 2光子励起顕微鏡による3D蛍光イメージング大脳新皮質の錐体細胞のみならず、これまでの蛍光顕微鏡では見られなかった海馬の細胞も見ることが可能になった。
他にも、私たちの研究室には10台以上の顕微鏡があり、用途に応じて使い分けています。こうした顕微鏡のシステムを整備するには、技術力の他にもそれ相当のコストがかかり、どの研究機関でも持つことができるというものではありません。そこで、私たちの研究室では国の研究支援事業である「先端バイオイメージング支援プラットフォーム(ABiS)」に参画して、全国でイメージング技術を必要とする研究者に支援を行っています。そのため、国内からさまざまな研究者が集まり、研究の幅が広がっています。例えば、慶應義塾大学の佐藤俊朗氏との研究では、いわゆるミニ臓器として知られる「オルガノイド」を撮影するための特殊な顕微鏡の開発を進めています。また皮膚疾患では、3D蛍光イメージングを用いて、明らかな原因が不明で治療が困難な掌蹠膿疱症の病態解明と新しい診断法の開発に、皮膚科の医師とともに取り組んでいます。さらに乳腺外科の医師とともに、AIを活用した画像解析と自動診断の研究も進めています。
最近では、スポーツの世界でもビデオ判定が導入されるなど、実際の現場での証拠が重要視されています。生物現象も同じで、「リアルタイムに観察したものこそ初めて証拠になる」が私たちの研究コンセプトで、まさに「百聞は一見にしかず」です。下村博士がGFPを発見して、もう半世紀以上がたちますが、まだ分子生物学の研究は、インビボ(in vivo:動物が生きたまま)の観察が主流にはなっていません。今後も、分子生物学や医学だけではなく、光学、工学、物理学、数理学など、さまざまな知を結集して、光イメージングにより生命現象や病態の解明を追求していきたいと考えています。