
新型コロナウイルスのスパイクタンパク質を組み込んだDNAから、その遺伝情報を転写して人工的に作られたmRNAが細胞内に運ばれると、スパイクタンパク質が作られて抗原が提示され、やがて免疫獲得となる——。ワクチンの実用化が早かったのは、この基本の仕組みがほぼ完成していて、mRNAの情報を書き換えるだけで済んだからだ。さらに、この仕組みを使えばどんなタンパク質でも合成可能になるという。
イラストレーション/北澤平祐

新型コロナウイルスのスパイクタンパク質を組み込んだDNAから、その遺伝情報を転写して人工的に作られたmRNAが細胞内に運ばれると、スパイクタンパク質が作られて抗原が提示され、やがて免疫獲得となる——。ワクチンの実用化が早かったのは、この基本の仕組みがほぼ完成していて、mRNAの情報を書き換えるだけで済んだからだ。さらに、この仕組みを使えばどんなタンパク質でも合成可能になるという。
新型コロナウイルスの出現で、それまであまり一般には知られていなかった用語を誰もが知ることになった。PCR検査しかり、ECMO(体外式膜型人工肺)しかり。メッセンジャーRNA(mRNA)もその代表であろう。
2020年秋ごろまでは、本当に新型コロナウイルスのワクチンが年内にできるかどうか疑問視されていた。しかし、同年12月に米ファイザー社と独ビオンテック社のmRNAを使った新型コロナウイルスワクチンをアメリカが緊急使用許可。日本でも2021年2月から特例承認され、医療従事者への接種が始まった。
これだけ早く遺伝物質のmRNAによるワクチンが作られ、さらに高い有効性だったことは、医薬品でのブレークスルー(飛躍的成功)となった。受賞は逃したが、ビオンテック社のカタリン・カリコ氏は、40年にわたってmRNAの研究を行い、体内で異物として認識されるmRNAの炎症反応を抑える物質を発見したことで、ノーベル賞の候補として注目された。
突如現れたように見えたmRNAだが、実は機は熟していた。
「新型コロナウイルスの遺伝子配列を中国が発表してすぐ、一気にmRNAワクチン開発が始まりましたが、その直前にすでに30~40の新薬候補の研究開発パイプラインが走っており、治験として人への投与が始まっていました。そもそも最初にmRNAがワクチンとして有望だったのは、感染症ではなくがんです。特にメラノーマ(皮膚がん)のmRNAワクチンの治験はかなり進んでおり、フェーズ2から3に入ろうとしていました」
東京医科歯科大学の位髙啓史教授はそう話す。位髙教授は、mRNA創薬黎明期から研究をしてきたこの分野のトップランナーの一人だ。乳がんや前立腺がんでも治験は始まっていた。
「もし新型コロナウイルスがなければ、mRNAはがんワクチンで知られるようになったかもしれません。しかし、これによって米モデルナ社やビオンテック社は全社を挙げて新型コロナウイルスワクチン開発に集中し、他の治験はいったんストップせざるを得ませんでした。そして、新型コロナウイルスワクチンがスピード承認されたのです」
mRNA創薬に関する最も大きな国際学会(International mRNA Health Conference)は、このモデルナ社やビオンテック社を中心に2013年にスタートし、カリコ氏も中心メンバーの一人であった。位髙教授はカリコ氏に誘われて第2回から参加していた。今は世界中が注目するmRNAだが、新型コロナウイルス出現前までは日本からこの学会に参加していたのは位髙教授だけだったという。
「mRNAを使ったワクチンで承認されたのは現在のところ新型コロナウイルスワクチンだけです。ただ、開発を当初から知っている者からすれば、この迅速な開発は不思議ではありません。なぜなら、mRNAから作られるタンパク質の情報の部分はいくらでも変えられるからです。mRNAはタンパク質の設計図である遺伝情報をコピーし、細胞内のタンパク質を合成する場所まで運ぶ役割を果たしますが、その仕組みは、タンパク質の種類に関係なく共通です(図1)。新型コロナウイルスワクチン開発に当たって、それまで別の創薬に使われていたmRNAを、そのまま新型コロナウイルス用に置き換えて作れたからこそ、これほど早くできたのです」
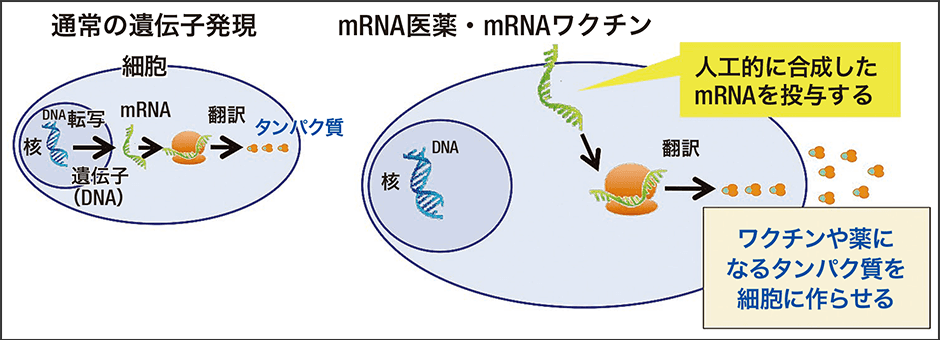
図1 mRNA医薬・mRNAワクチンの仕組みmRNAはタンパク質の遺伝情報をコピーし、細胞内のワクチンや薬になるタンパク質を合成する場所まで運ぶ役割を果たす。これはタンパク質の種類に関係なく共通である。
治験が進んでいたことにより、人への投与に関する安全性のデータがすでに存在した。それを転用して、mRNAの情報の部分だけを新型コロナウイルスに置き換えたため、スピード開発が可能になったという。
「現在最も大変なのは、mRNAの大量生産であると聞きます。がんワクチンの治験であれば比較的限られた人数分のmRNAを作ればよかったものの、新型コロナウイルスでは急に何億人分、何十億人分を製造することになったからです」
作り替えが容易、かつ短期間で開発できることは、大きなメリットとなった。今後も、変異ウイルスなどに対応するワクチンは「設計は1週間もあれば技術的には可能」だと、位髙教授は言う。
他の感染症に対する研究も進んでおり、2021年9月にモデルナ社は新型コロナウイルスと季節性インフルエンザなど複数の呼吸器疾患を併せて予防できる混合ワクチンの開発に着手したと発表した。位髙教授もmRNAを使った感染症ワクチンの研究を、国立感染症研究所と共同で始めている。
「将来、mRNAワクチンはあらゆる感染症に対応できる可能性があります。ウイルスの情報に基づいてmRNAを設計して、ワクチンとして投与する方法は、基本的にはどのようなウイルスでも共通です。さらに、新型コロナウイルスでは非常に高い有効率が得られて世界を驚かせましたが、これと同等の有効率が他のウイルスに対してでも得られれば、従来の不活化ワクチン等を上回る効果を持つワクチンとなることも期待されます。実際、現状のインフルエンザワクチンの有効率と比べると、新型コロナウイルスワクチンの有効率は非常に高いのです。さらに、インフルエンザは毎年流行する株が変わりますが、mRNAであれば設計を変えることで簡単に変異に対応できます」
mRNAはコスト的にも優れていると位髙教授は話す。
「これはモデルナ社が言っていることですが、この20年の間に、エボラウイルスやジカウイルスなど新種のウイルスの発生報告が80ほどありました。ですが、実際にワクチン開発が行われた感染症はたった3つです。なぜかといえば、流行地域が限られた感染症が多く、ワクチンを作ろうと思っても製薬会社としては利益が出ないからです。ワクチンの値段をあまり高くして、接種してもらえないとなったら意味がありません。その点、mRNAであれば、フォーマットを変えず、遺伝子の情報を変えるだけなので、迅速かつ低コストで新規ワクチンの開発が可能となります。一つひとつのパイは小さいとしても、開発されなかった77種のウイルスに対するワクチン開発が実現すれば、途端に大きなマーケットになります」
位髙教授はもともと遺伝子ともmRNAとも関係のないキャリアからスタートした。東京大学医学部を卒業後、整形外科の臨床現場で10年ほど働いていたという。ただ、どれだけ手術の技術を学び目前の患者を治したいと願っても、どうにもならない疾患は少なくなかった。新しい治療法の実現を夢見て、1999年に大学院に進学。そこで遺伝子治療のテーマに出合った。東京大学大学院工学系研究科の片岡一則教授と共同で、遺伝子を運ぶ薬物送達システム(DDS)の研究に携わった。
「当時はDDSを用いて運ぶ遺伝物質としてはDNAが中心でした。私自身も長くDNAを運ぶためのDDS研究に従事しましたが、臨床応用を考える立場からは、DNAはリスクが高いのが現実でした。細胞に取り込まれたDNAが、ゲノムDNAに挿入され、変異を起こしてしまう恐れがあるからです。DNAは細胞に侵入し、さらに核にまで到達しないと情報が転写され翻訳されません。核にDNAが入ると、ゲノムの相同組み換えが一定の確率、100万回に1回程度は起きる計算となります。この相同組み換えは生命の進化のエネルギーでもあり、原理的にゼロにすることは難しいのです。100万人に1人の確率というのは少ないように思われるかもしれませんが、少しでもリスクがあるとなると、治療の対象となる疾患は非常に限られてしまいます」
2000年に先天性免疫不全症の幹細胞遺伝子治療が成功したが、数年後に患者が白血病を発症したため、安全性の問題が取りざたされていた。
位髙教授は、DNAを使っている限り、なかなか承認されず、展望は開けないと感じた。そこで、DNAから一歩進んだmRNAを使えないかと考えたという。それまでmRNAは不安定で壊れやすく、また強い免疫反応を引き起こすために、薬として使用することは難しいと思われていた。しかし過剰な免疫反応を防ぐ方法や、壊れないように脂質の膜に包む方法などが次々と発表された。
「面白いことに同じ研究をやっている人たちは、同じような時期に同じようなことを思いつくものです。2000年代の後半になって、カリコ先生や他の遺伝子治療の研究者から、mRNAを薬として用いる可能性についての発表がいくつか見られるようになり、シュードウリジンと呼ばれる炎症反応を抑える物質の発表もありました。私もmRNAの可能性を感じて研究に着手しましたが、当時はmRNAを作ること自体が大変でした。DNAに比べてRNAは脆くて、すぐに壊れてしまいます。幸いにも、私はDNA用のDDSを作っていて、それをほぼそのままRNAにも使うことができました。mRNAを動物に投与しタンパク質が作られることを発表した私の最初の論文は2013年に出版されています」
ビオンテック社は2008年、モデルナ社は2010年に設立された。mRNA創薬の黎明期である。そこに至るには、mRNAを作る技術に関するブレークスルーがいくつかあった。
「mRNAを比較的、効率よく作れるようになったのも2000年代後半です。かつては細胞や動物から抽出したmRNAを薬として使うことが真面目に議論されていた時期もありました。一方、mRNAを人工的に合成する方法として、インビトロ転写といって、鋳型になるDNAを設計し、試験管内でそれを転写してRNAを作る技術が確立し、広く使われるようになりました」
mRNAワクチンが高い有効性を示したこともあり、今後は病気の治療に使われる医薬品への期待も高まっている。この分野では、モデルナ社と英アストラゼネカ社のチームが虚血性心疾患の治験を始めている。
「治療にmRNAを使えるようになるかどうかは、さらに情報の部分が重要となります。どういう病気に対して、どの標的細胞に、何のタンパクを作らせるか。これは医学や生物学の基礎研究から得られる情報です」
位髙教授が研究に着手するのは、軟骨形成を促進させるタンパク質を作るmRNAだ。軟骨がすり減って膝などが痛む、変形性関節症の治療薬の研究を進めている。
「mRNAのような新しい方法で対象となるのは、アンメット・メディカル・ニーズ、つまりいまだ治療法が見つかっていない疾患に関する医療ニーズです。軟骨がすり減る疾患に関して、治せる薬は今のところ一つもありません。これを何とかできないかと、軟骨細胞の機能を高めることが知られているタンパク質をコードするmRNAを動物の膝関節に注射する実験を行って、軟骨変性進行を抑える効果があることがわかりました(図2)。軟骨の再生医療を実現する可能性のあるmRNA医薬として、現在さらに動物を使った研究を進めていて、将来は東京医科歯科大学、東京大学の整形外科と共同での臨床試験を計画しています」
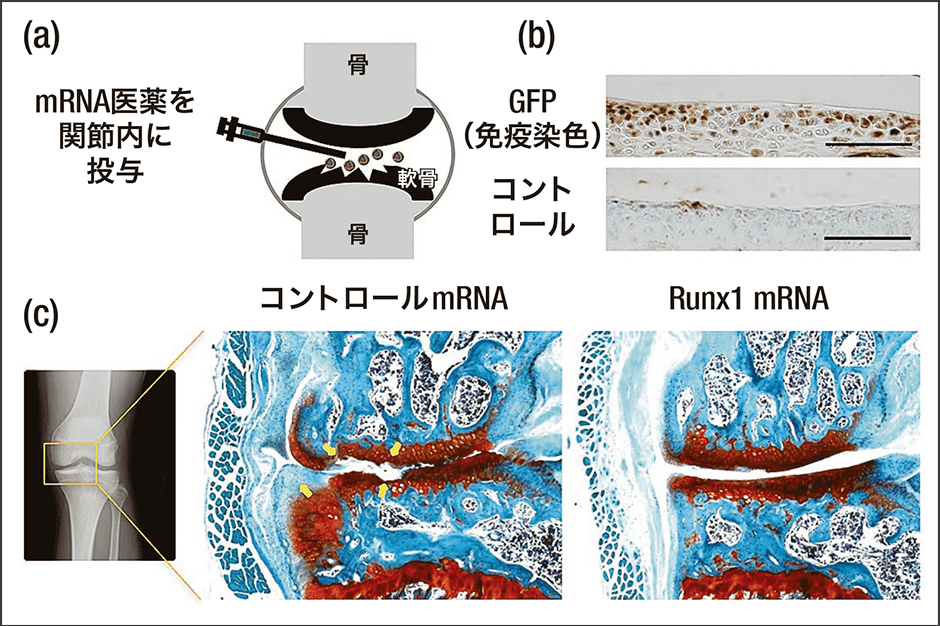
図2 mRNA関節内投与による変形性関節症治療(a)mRNAを関節内投与。(b)GFP(緑色蛍光タンパク質)を発現するmRNA投与後の軟骨組織(図はGFPの免疫染色)。軟骨細胞に広く発現が観察される。(c)変形性関節症モデルマウス(半月板、靱帯切除による関節不安定化)に対する軟骨誘導性転写因子(Runx1)を発現するmRNAの投与。Runx1 mRNAによって軟骨変性が抑制される。(Sci Rep 2016, 6:18743より引用改変)
これまで治療法のなかった疾患に対して、mRNA医薬は新しい治療を実現できる可能性があるという。
「軟骨だけではなくて、さまざまな可能性を模索していきたい。もう一つ我々が研究を進めているのは脳の病気に対する治療薬です。既存の薬では太刀打ちできない病気の代表例が、脳や脊髄などの神経系でしょう」
「BDNF(脳由来神経栄養因子)」という神経系を保護するタンパク質の存在は以前から報告されていたが、それを脳に投与しても標的にうまく届かなかったという。タンパク質の形ではBDNFのライフタイムは短く、効果は数時間未満と非常に短いことも理由の一つだった。
そこで位髙教授は、BDNFを作るmRNAを作り、虚血性脳疾患(脳梗塞などの疾患)のモデルラットに投与した。結果、何もしないままのラットでは虚血に伴って神経細胞は徐々に死滅し、2週間後に生き残った神経細胞は5%未満だったことに比して、mRNAを投与したラットでは半分の細胞が生き残ったという。
「mRNA投与であればタンパク質を数日間にわたり分泌します。さらにBDNFの神経細胞への作用の仕方も、mRNA投与とタンパク質での投与の場合とでは異なることがわかりました。特に虚血発作が起こった直後でなく、2日経ってからmRNA投与しても十分な神経保護効果が得られたことは、我々にとっても驚きでした」
動物実験では脳室に注射した。人間でも、脳出血などで手術する際にmRNAの投与を行うことは十分可能であるという。
「もちろん血中投与ができればそのほうが患者さんには投与しやすい方法ですが、mRNA医薬はまだ初めての薬で、血中投与して全身に薬が回るということには、慎重な検討が必要です。mRNA医薬の最初の適用として軟骨の治療を考えた理由の一つに、関節内への注射となるため、mRNAが身体の他の部位に分布しにくいという点があります」
mRNAワクチンも、まだ課題は多い。例えば、ワクチン接種後、発現した抗原タンパクが接種部位にとどまるのか、全身を回っているのかは、まだはっきりとはわかっていない。
「そこがもっとわかれば、それに合わせてさらに改良したmRNAの作り方が出てくるのかもしれません。語弊を恐れずに言うと、まだわからないことばかりなのです。しかし、mRNAが正しく作られれば、体内で目的のタンパク質は確実に作られます。どんなタンパク質でもそこは同じです。むしろタンパク質が作られた後、身体の中で何が起こっているのか、副反応の問題など、そこがまだまだわかっていないのです。まだこれから研究が必要な部分はたくさんあります」
一方、位髙教授は「mRNAの可能性は無限大」だと言う。
「mRNAはどのようなタンパク質でも作ることができる、そこは従来の医薬品と異なる最大の利点です。私など思いも寄らないアイディアが今後出てくるかもしれません。さまざまな専門分野の先生たちと協力して、新しい道を切り開いていきたいと思います」