腸内の有機酸は、主に下部消化管において常在性の嫌気性菌により産生される。ヒトのみならず豚、犬や猫などの伴侶動物、あるいはマウスといった実験動物においても、このような腸内細菌による有機酸産生は同様である。腸内で産生される主要な有機酸(短鎖脂肪酸)である酢酸(炭素数:2)、プロピオン酸(炭素数:3)および酪酸(炭素数:4)は、体内に吸収されてエネルギー源となる。特に、反芻動物では、反芻胃内に常在する微生物群により産生される短鎖脂肪酸は重要なエネルギー源となっていることが知られている。もちろん、酸であるから腸内環境を酸性化することにより、食中毒菌や感染性の好ましくない微生物群の増殖を抑制してくれる。例えば、筆者らは、日和見感染起因菌として世界的に問題となっている多剤耐性菌Acinetobacter baumanniiのマウス腸管感染モデルにおいて、ビフィズス菌の投与によって腸内の酢酸濃度が上昇し、A. baumanniiの増殖が顕著に抑制されることを明らかにした。さらに、ビフィズス菌に加えてガラクトオリゴ糖を併用投与することによりビフィズス菌の感染防御作用が増強される。この研究では、図に示すように、マウスの腸内のA. baumannii菌数と腸内酢酸濃度に極めて良い負の相関が認められ、一方でビフィズス菌の数と腸内酢酸濃度には正の相関が認められた。
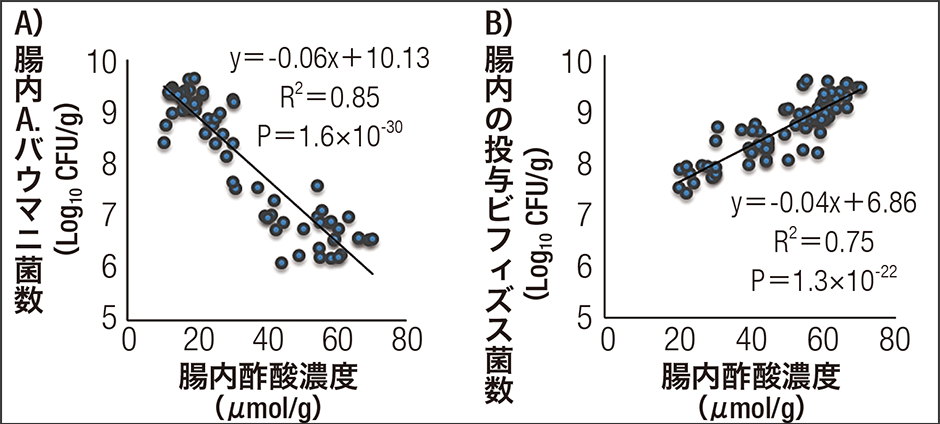
図 A.バウマニ感染マウスの腸内における
A)A.バウマニ生菌数と腸内酢酸濃度の関係、
B)投与されたビフィズス菌の生菌数と腸内酢酸濃度の関係(文献*1から改変して引用)
短鎖脂肪酸にはさまざまな生理作用が報告されているが、最近、特に我々の免疫機構に有意な影響を与えていることがわかってきている。例えば、酪酸は、腸管粘膜を介して免疫の制御(過剰な炎症やアレルギー反応などを鎮める)において重要な働きをする制御性T細胞の分化を促進することが報告されている。前述のマウス実験モデルにおいて酢酸は、腸管上皮細胞のバリア機能を高めることによっても腸管感染防御作用に寄与する。さらに最近では、酢酸が大腸菌などの腸内細菌科菌群に特異的な免疫グロブリン(IgA)の産生を促進することにより、我々の生体防御に貢献していることも明らかにされた。一方、プロピオン酸はその抗菌作用により食品の保存料として使用されているが、プロピオン酸の継続的な摂取が自己免疫疾患である多発性硬化症の症状を改善すること、およびこの作用メカニズムとしてプロピオン酸による制御性T細胞の活性化が示唆されている。
腸内に生息するさまざまな菌群が有機酸を産生しているが、腸内細菌群による有機酸代謝における異なる菌群間の互助関係(cross-feeding)が知られている。例えば、ビフィズス菌自身は酪酸を産生しないが、ビフィズス菌の産生する酢酸や乳酸を腸内最優勢のBlautia coccoides群に属する酪酸産生菌が利用して酪酸を作る。小腸下部の常在菌として知られるStreptococcus(連鎖球菌)属細菌が多様な炭水化物を代謝して産生した乳酸をVeillonella属細菌が利用する、といった具合である。ちなみに、最近、運動と腸内細菌の関係で興味深い報告があった。アメリカ・ボストンマラソンの参加選手から、レース前後の10日間ほどにわたって便を提供してもらい、菌叢の変化を解析したところ、レース前に比べてレース後に増加していた菌群としてプロピオン酸産生性のVeillonella属が同定された。Veillonella属は運動によって産生された乳酸を利用してプロピオン酸を産生することが示唆されており、実際にレースに参加したマラソンランナーの腸内から分離されたVeillonella属の一種であるV. atypicaをマウスに投与すると、マウスのトレッドミル走行能が上昇したと報告されている。
- *1 Asahara T, Takahashi A, Yuki N, et al. Protective effect of a synbiotic against multidrug-resistant Acinetobacter baumannii in a murine infection model. Antimicrob Agents Chemother, 60: 3041-3050, 2016. doi: 10.1128/AAC.02928-15.
- *2 Furusawa Y, Obata Y, Fukuda S, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature, 504:446-450, 2013.doi: 10.1038/nature12721.
- *3 Takeuchi T, Miyauchi E, Kanaya T, et al. Acetate differentially regulates IgA reactivity to commensal bacteria. Nature, 595: 560-564, 2021. doi: 10.1038/s41586-021-03727-5.
- *4 Duscha A, Gisevius B, Hirschberg S, et al. Propionic acid shapes the multiple sclerosis disease course by an immunomodulatory mechanism. Cell, 180: 1067-1080, 2020. doi: 10.1016/j.cell. 2020.02.035.
- *5 Rivière A, Selak M, Lantin D, et al. Bifidobacteria and butyrate-producing colon bacteria: Importance and strategies for their stimulation in the human gut. Front Microbiol., 2016 Jun 28;7:979. doi: 10.3389/fmicb.2016.00979.
- *6 Louis P, Flint HJ. Formation of propionate and butyrate by the human colonic microbiota. Environ Microbiol., 2017 Jan;19(1):29-41. doi: 10.1111/1462-2920.13589.
- *7 Scheiman J, Luber JM, Chavkin TA, et al. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nat Med, 25:1104-1109, 2019. doi: 10.1038/s41591-019-0485-4.