細胞と細胞の間にある細胞外環境は、細胞から分泌されるタンパク質などで構成され、細胞の機能と深く関与する。血管細胞でも同様で、血圧と血流のストレスにさらされている動脈においては、血管細胞の一つである平滑筋細胞が分泌するタンパク質・エラスチンが主成分の、ゴムのような伸縮性を持つ弾性線維が、大動脈瘤や大動脈解離などの動脈疾患と深く関わっていることがわかってきた。細胞外環境を用いて発症を予測する「バイオマーカー」の研究も進行中だ。
特集 血管を知る 「動脈疾患」に関与する「細胞外環境」のタンパク質
構成/大内ゆみ イラストレーション/千野六久
生体を構成する細胞は、それ自体だけで機能しているわけではなく、細胞外環境という細胞間の微小環境の変化に応答して、細胞骨格(細胞の形を維持する細胞内の組織)や動態を変化させて体を安定した状態に保っています。細胞外環境が細胞を変化させ、細胞の運命を制御しているといっても過言ではないでしょう。
細胞自体が分泌するタンパク質の構造物
この細胞外環境にはさまざまな因子が存在していますが、主な成分として、細胞外マトリックス(以下、マトリックス)があります。マトリックスは、いわば細胞のすみかのようなもので、細胞自体が分泌するコラーゲンやプロテオグリカンなどの高分子複合体でつくられた構造物です。ここに細胞がきちんとはまり込むことによって、私たちの体はつくられているのです。
マトリックスは組織ごとに異なり、骨であれば骨芽細胞が分泌するマトリックスが石灰化されて硬い組織をつくり出しています。もちろん血管も同様に、細胞がつくり出すマトリックスによって、しなやかさと強さを維持しています。この血管のマトリックスの異常が、脳血管や心血管の疾患の病態に関連していることが、近年、注目されています。私たちは、血管細胞とマトリックスとの連結やその応答を中心とした研究により、代表的な大動脈疾患である大動脈瘤、大動脈解離の病態解明に取り組んでいます。
血管は、内側から内皮細胞、平滑筋細胞、線維芽細胞の3層構造からなり、主要なマトリックスとして、平滑筋細胞がつくり出す弾性線維と、線維芽細胞がつくり出す膠原線維があります(図1)。弾性線維はエラスチンというタンパク質からなり、力を加えると伸び、力を除くと元に戻るといったゴムのような伸縮性を持ちます。膠原線維の成分はコラーゲンで、血管が引っ張られる力に対し耐えられる強度(引っ張り強度)を保っています。
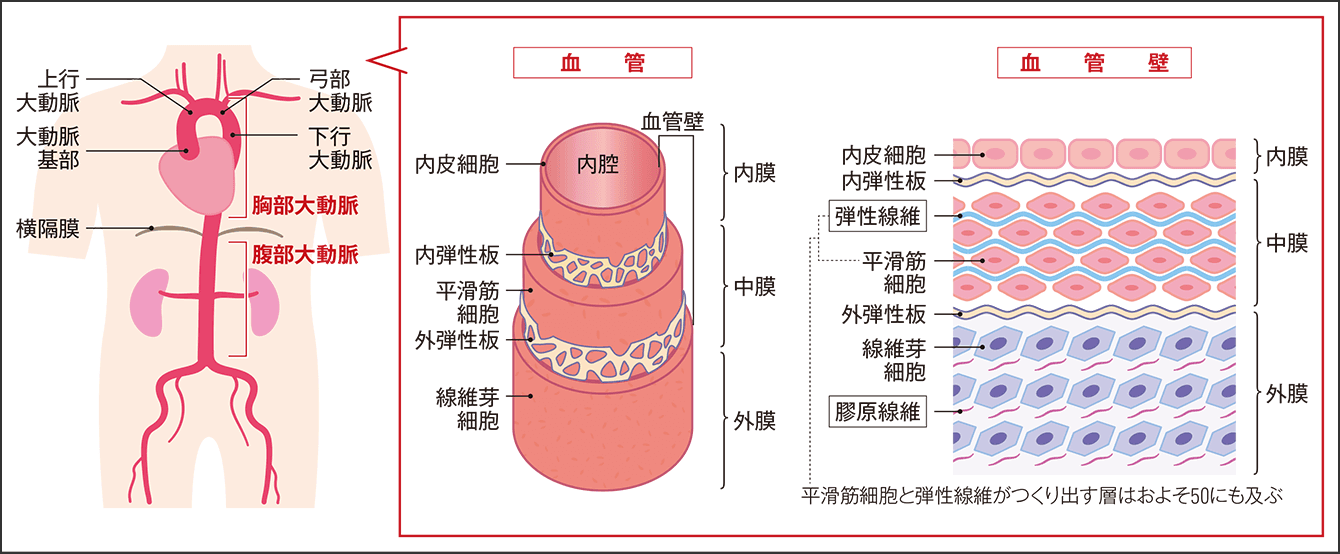
図1 大動脈の血管の構造大動脈は、胸部から腹部を走行する血管で、全身に血液を押し出している。大動脈の血管壁は、血圧や血流によるメカニカルストレスに耐えるため、他の血管よりも弾性線維が豊富で層が厚い。この部位で生じる重要な疾患に、大動脈瘤と大動脈解離がある。
動脈で特に重要なのが弾性線維で、静脈よりも豊富に存在しています。動脈の中でも大動脈は、心臓収縮期に血管を拡張させて、拡張期には元に戻る作用があるため、血液を末梢へ満遍なく押し出します。このように、大動脈の血管壁は絶えず血圧・血流による伸展張力やずり応力といったメカニカルストレス(機械的刺激)にさらされています。そのため、弾性線維がよく発達していて、平滑筋細胞と弾性線維がまるでタマネギのように相互に重なり合い、およそ50層に及びます。よく加齢によって血管が硬くなるといわれるのは、弾性線維の減少や断裂により伸縮性が低下し、膠原線維による引っ張り強度が強くなるためです。
弾性線維の断裂や凝縮が認められた
もう20年ほど前になりますが、この弾性線維の形成にFibulin-5(Fbln5)というタンパク質が必須であることを報告しました。Fbln5は、当時発見されたマトリックスの一つで、ヒトの生体内、特に弾性線維が豊富な部位に存在していることがわかっていました。
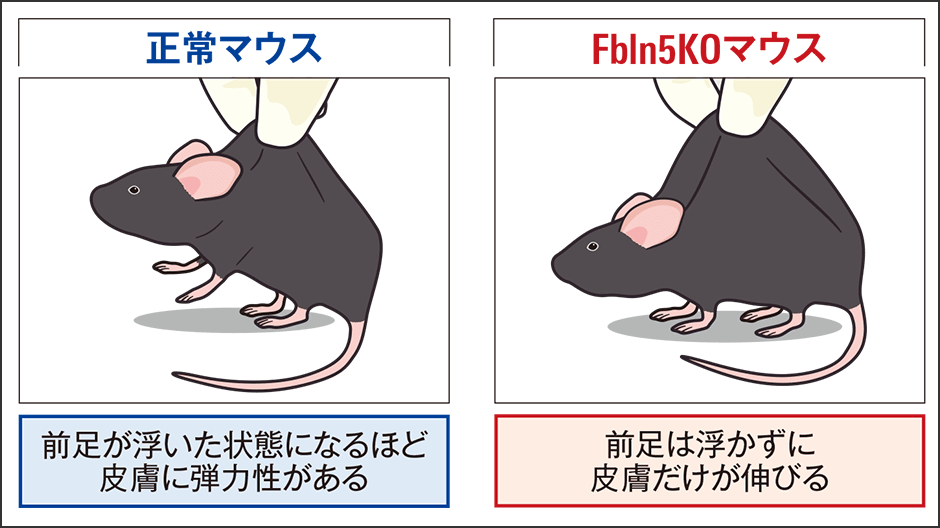
この研究では、Fbln5を欠損させたマウス(Fbln5KOマウス)を作製して、成長過程を観察しました。Fbln5KOマウスは、成体まで成長するものの、若年時から大動脈が伸びきって長くなり、皮膚をつまむと伸びてスカートのように広がるという衝撃的な現象が生じていたのです(図2)。そして、その現象は加齢につれ、進行していくこともわかりました。電子顕微鏡による観察では、弾性線維の断裂や凝縮が認められました。さらに他にも、肺気腫、骨盤内臓器脱(ぼうこう・子宮・直腸・膣などが脱出する)など、本来、弾性線維が豊富な肺、膣といった部位に異常が見られました。この研究成果が、現在の研究への出発点になったのです。
 出典:Yanagisawa H, et al. Nature, 415:168-171, 2002を参考に作成
出典:Yanagisawa H, et al. Nature, 415:168-171, 2002を参考に作成
図2 Fbln5を欠損させたマウスFbln5を欠損させたマウスは、背中の皮膚をつまむと正常なマウスに比べて伸び、スカートのように広がった。
大動脈瘤は、通常は直径20㎜程度の大動脈がこぶ状に1.5倍以上にまで膨らんだ状態で、自然には治癒せず、破裂すると大出血により死に至ることもある非常に危険な疾患です。動脈硬化が原因の一つといわれているものの、詳しい発症メカニズムはまだわかっていません。瘤ができる部位によって、大きく胸部大動脈瘤、腹部大動脈瘤に分かれますが、胸部大動脈瘤は先天性のマトリックスの異常で起きることが多いとされています。しかし、前述したFbln5KOマウスでは、弾性線維が破壊されているものの、大動脈瘤は発症しませんでした。そこで注目したのが、Fbln5と同じファミリーに属するFibulin-4(Fbln4)です。
Fbln4は、弾性線維と膠原線維の形成にも関与し、Fbln4を欠損させたマウスでは大動脈瘤の破裂などで生後まもなく死亡することが報告されていました。
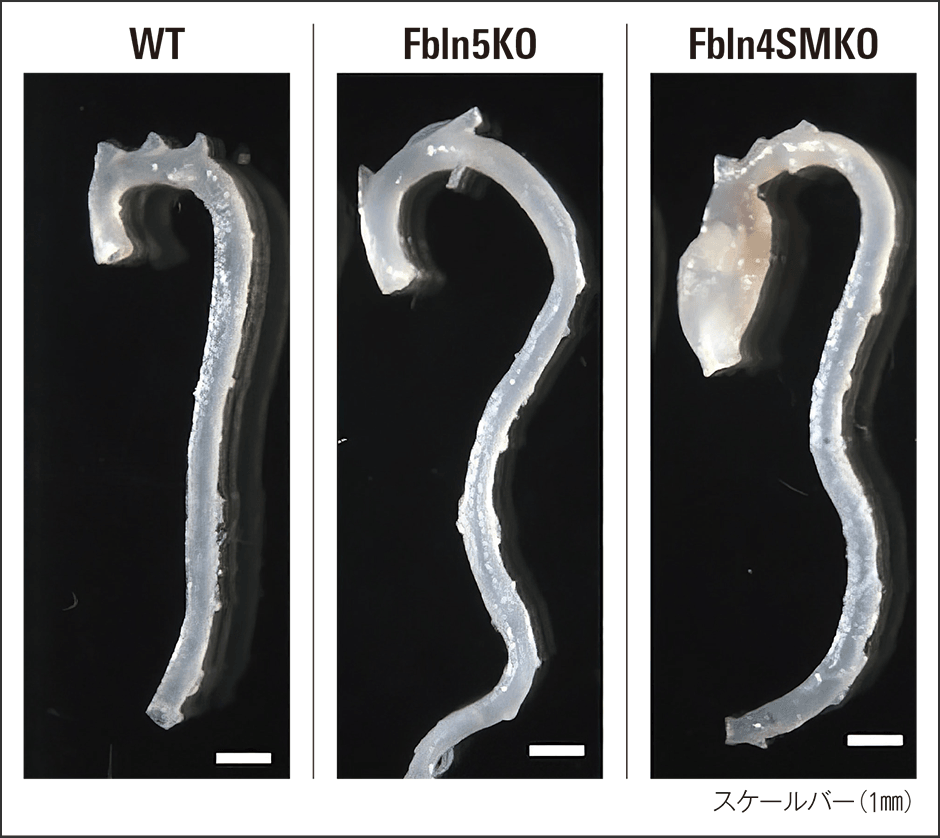
私たちは、新生仔の致死を回避し研究が継続できるように、血管平滑筋細胞のFbln4を特異的に欠損させたマウス(Fbln4SMKOマウス)を作製しました。すると、生後3カ月齢で大動脈瘤が全例に認められたのです(図3)。
 出典:Sugiyama K, et al. Cell Reports Medicine,, 2021 Apr 28;2(5):100261.
出典:Sugiyama K, et al. Cell Reports Medicine,, 2021 Apr 28;2(5):100261.
図3 上行大動脈瘤の比較左から野生型マウス(WT、遺伝子改変ではない)、Fbln5KOマウス、Fbln4SMKOマウスの上行大動脈瘤の比較。Fbln5KOマウスでは大動脈瘤は発症しないが、上行大動脈の伸長が見られる。両者ともに下行大動脈伸長と蛇行が認められる。
では、大動脈瘤が生じなかったFbln5KOマウスとFbln4SMKOマウスで、血管壁の弾性線維の形成に違いがあるのか、電子顕微鏡で比較しました。両者とも弾性線維が断裂して明らかな異常を示していました。しかし、弾性線維と平滑筋細胞をつなぐエラスチン・エクステンションという部分に着目すると、Fbln5KOマウスでは、その連結がかろうじて保たれているのに対し、Fbln4SMKOマウスでは連結が消失していました。この結果から私たちは、弾性線維と平滑筋細胞の連結が切れてしまうことが大動脈瘤の発症の原因の一つではないかと考えました。
大動脈瘤で過剰に発現するタンパク質
弾性線維と平滑筋細胞との連結についてもう少し詳しく説明すると、弾性線維の一部が平滑筋細胞の表面にあるインテグリンという受容体を介して結合し、この接着部分(接着斑)から平滑筋細胞内の筋収縮線維につながっています。つまり、このエラスチン・コントラクタイルユニットと呼ばれるつながりを通して、弾性線維がメカニカルストレスなどの外部からの刺激を伝えて、そのシグナルを平滑筋細胞が受け取り、細胞外の変化に応答することが可能になっているのです。
さらに、Fbln4SMKOマウスの大動脈瘤において、どのような分子の変化があるかを調べた結果、発症段階から血管壁の内皮細胞とその近くの平滑筋細胞で、トロンボスポンジン1(Thbs1)が過剰に発現していることがわかりました。Thbs1は、マトリックスの一つとしてさまざまな組織に存在するタンパク質ですが、正常の成体マウスの血管ではその発現は顕著に低下しています。
このThbs1をFbln4SMKOマウスから欠損させたところ、瘤の形成が抑えられました。つまり、弾性線維と平滑筋細胞との連結が消失している場合に、Thbs1が過剰に発現し、大動脈瘤の進行に影響する可能性が示されたのです。加えて、平滑筋細胞にメカニカルストレスによる伸展刺激があるとThbs1が分泌されることがわかり、細胞が外力を感知して応答する仕組みとそのシグナル伝達において重要な役割を果たしていることが考えられました。
一方で、弾性線維と平滑筋細胞との連結が切れているにもかかわらず、なぜ細胞が応答してThbs1が上昇してくるのかという疑問も残ります。この疑問に対し、平滑筋細胞が血管の伸展刺激を正確に感知できないために、メカニカルストレスの応答異常を起こしているのではないかと考えています。
さらに、当大学の心臓血管外科グループの協力を得て、ヒトの胸部大動脈瘤患者28例の病変部組織を解析した結果、Thbs1の発現が増加していることを確認しました。Thbs1がマウスだけではなくヒトにも発現していることから、Thbs1の抑制が大動脈の治療に有用である可能性が示されました。
現在、大動脈瘤に対しては、瘤が小さく破裂する危険性が低い場合は、血圧管理など生活習慣の改善に加え、危険度が高い大きさになった場合には瘤を人工血管に置き換える人工血管置換術やステントグラフト内挿術(血管内に人工血管を埋め込む)といった治療が主で、有効な薬物療法はありません。将来的に、Thbs1をターゲットにした治療薬などの開発につなげられるよう、さらなる病態の解明を進めたいと考えています。
大動脈の疾患には、大動脈瘤の他に大動脈解離があります。大動脈の中膜が裂けて分離した層と層の間に血液が流れ込むことで、血管の壁が薄くなり、破裂しやすい状態になる疾患です。大動脈瘤と同じく危険な疾患で、特に心臓近くの上行大動脈に至るまで解離が及んだ場合は致死率が高まります。血管が破裂した場合、もしくは破裂の危険がある場合は人工血管置換術が行われます。
この大動脈解離についても、ヒトの疾患の遺伝子情報を基に作製した大動脈解離モデルマウスを用いて、どのような分子変化が血管壁に起きているか、経時的に解析する研究を進めています。ちなみに大動脈解離は、大動脈瘤のようにFbln4の欠損が直接関与しているわけではなく、別のメカニズムが介在していると考えています。
生体成分を用いたバイオマーカー
また、これまでの研究結果を生かして、大動脈瘤や大動脈解離の発症を予測するためのバイオマーカーを測定するプロジェクトも進行中です。バイオマーカーとは、疾患の有無や病状の変化、治療の効果の指標となる生体内の物質で、前立腺がんではPSA(前立腺特異抗原)、糖尿病では血糖値などさまざまなバイオマーカーがあります。現在、大動脈瘤は健康診断などで偶然、見つかることが多く、定期的に超音波検査やCT検査を受けて、瘤の大きさを評価する必要があります。大動脈解離にいたっては突然に発症し、治療後も再解離のリスクがあり、やはり定期的な画像検査が必要です。どちらも、瘤の有無や破裂、解離を予測するバイオマーカーは存在していません。
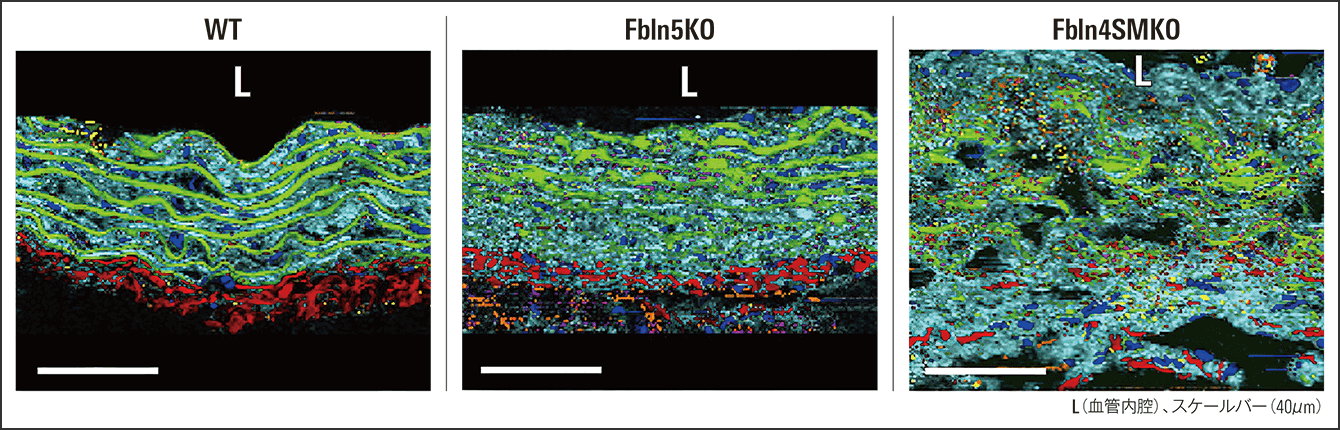
このプロジェクトでは、物質に光を当てて得られる散乱光を利用して分子の構造の情報を得るラマン分光法の応用を考えています。ラマン分光法の測定とその解析によるアプローチで、生体成分のスペクトル情報(光や信号などの波を成分に分解し、成分ごとの大小を配列したもの)の取得や成分の画像化が可能です(図4)。現段階では、前述した大動脈瘤モデルマウスやFbln5KOマウス、ヒトの胸部大動脈瘤病変をラマン分光法で測定して解析した結果、大動脈瘤モデルマウスとヒト大動脈瘤のみに存在するマトリックス成分の構成情報が明らかになっています。こうしたラマン分光法による疾患特有のマトリックス成分の情報が、バイオマーカーとなり得る可能性があると考えています。
 出典:Sugiyama K, et al. Cell Reports Medicine, 2021 Apr 28;2(5):100261.
出典:Sugiyama K, et al. Cell Reports Medicine, 2021 Apr 28;2(5):100261.
図4 ラマン分光法によるラベルフリーイメージングラマン分光法で得られた、スペクトル情報と空間情報を基に生成された画像(ラマンイメージング)。生体成分を可視化している。弾性線維(緑)、膠原線維(赤)、核(青)、アグリカン(黄色)、バーシカン(マゼンダ)、脂質(オレンジ)、および残留細胞外マトリックス(シアン)。
現在はまだサンプルとして組織片を用いていますが、簡便に血管壁のマトリックスを測定するような機器が開発できれば、現行の画像検査よりも詳細で正確な評価が可能になるでしょう。
細胞と細胞外環境の応答は、人工血管などの生物工学、iPS細胞をはじめとした幹細胞による再生医療など、さまざまな分野で研究が広がっています。また、私たちと同様に血管を対象とした研究も国内外で行われ、最新の知見が集積されています。例えば、前述したエラスチン・コントラクタイルユニットの構成因子をコードする遺伝子変異が複数発見されており、大動脈瘤や大動脈解離のリスクがわかる遺伝子パネル検査の開発につながる可能性があります。今後は他の研究グループとともにチームとして、研究のレベルアップを図っていくことも必要でしょう。そして、基礎から臨床、臨床から基礎のコラボレーションで研究を進め、治療や予防につなげていきたいと考えています。