現代の生物学は、顕微鏡の発明でその端緒が開けたと言ってもいい。そしてDNA二重らせん構造の発見は画期的で、分子生物学という分野が確立された。近年のゲノム配列の解析の成功で、生命の追究が一気に進むかと期待されたが、むしろ謎は深まるばかりだった。つまり遺伝子の情報だけでは、作られるタンパク質がどのように動き、どのように配置されるかが分からないのだ。生命の原理を知るには、動きを実際に見る必要があり、それには生体イメージングが欠かせない。
特集 進化する「視覚化」 〈巻頭インタビュー〉
細胞内の可視化で生命の原理に迫る!
構成/飯塚りえ
生物学の始まりは、見ることです。遡れば17世紀後半、織物商人だったオランダのアントニ・ファン・レーウェンフックが単式顕微鏡を発明します。レーウェンフックはこの顕微鏡を用いて、微生物や精子を発見しています。同じ頃、英国王立協会の科学者、ロバート・フックが顕微鏡でコルクの細胞壁の観察に成功しました。この細胞壁が小部屋の集まりに見えたことから、それを「cell(小部屋)」と名づけたのです。生物学の「cell(細胞)」という用語は、これが由来です。
生命を理解するにはゲノム解析では不十分
19世紀末には、エックス線や電子が発見され、20世紀初頭には電子レンズの開発が始まります。1930年代前半には電子顕微鏡が開発され、分解能が格段に高くなったことで分子レベルの観察が可能になったのです。
機器の開発と並行して、生物学は、1953年、DNAの二重らせん構造の提唱によって飛躍的な発展を遂げました。以降、「分子生物学」という学問分野として確立され、多くの研究が成果を上げています。
こうした学問分野の発展の背景にあるのは、最先端の技術です。1970年代の後半に登場したDNAのシーケンシング技術、1980年代に登場したポリメラーゼ連鎖反応(PCR)技術など、画期的な技術が開発されたことが、生物学に新しい視点をもたらしたのです。
2003年にはヒトゲノムの解読が完了したことが宣言され、さらに2022年には、アメリカ国立ヒトゲノム研究所などの国際チームが、当時の技術では解読困難だった約8%についても解読したことを発表し、完全解読に至っています。
ヒトを含む多くの生物のゲノム配列が解明されたことで、世界は「生命現象の謎が次々と明かされる!」と沸いたのですが、私たちはむしろ、生命を理解するには、ゲノムを解析しただけではまったく不十分で、まだまだ研究が必要だと知ることになりました。
というのも、生物の塩基配列を解析して遺伝子の情報を得たというのは、言ってみれば、生体の部品であるタンパク質の情報を網羅的に手に入れたということですが、しかしそれだけでは、生命の謎が解けたとは到底言えないのです。
それはなぜかといえば、タンパク質という部品の情報が分かっても、その部品によって作られる回路や、それぞれの部品をどのタイミングでどこにどのように導入するかは分からないからです。
例えば、プラモデルであれば、部品の情報だけで、作ることができるでしょう。しかし、私たちは部品を知っていても、生物を作ることはできません。
細胞の中で起こっている反応を可視化
生物を作れないのは、まず、部品の回路のつながりであったり、その部品をいつ、どこに組み込むのか、といった部品の動き方を知らないからです。仮に生命を理解するということが、それを部品から作れるようになることだとすると、部品の配列を知っただけでは、そのゴールにたどり着けない、部品が動いている回路の状況を見ることが必要だと分かったのです。
つまり、生命を理解するには、生きた細胞の中で起こっている反応をライブで追いかけ、動きを可視化し、ありのままに記録するという試みが必要でした。
そこで登場したのが、私が携わっている生体ライブイメージングです。
始まりは、何といってもGFP(Green Fluorescent Protein:緑色蛍光タンパク質)の発見でしょう。ノーベル化学賞を受賞した下村脩博士が、世界で初めてオワンクラゲからGFPを発見したのは1960年代のことです。発見されたタンパク質は、青色の光を照射すると緑色の蛍光を発します。こうしてGFPを合成する遺伝子配列が特定されたことによって、その配列をさまざまな細胞に導入し、GFPという目印によって対象を可視化するという手法が開発されたのです(図1)。
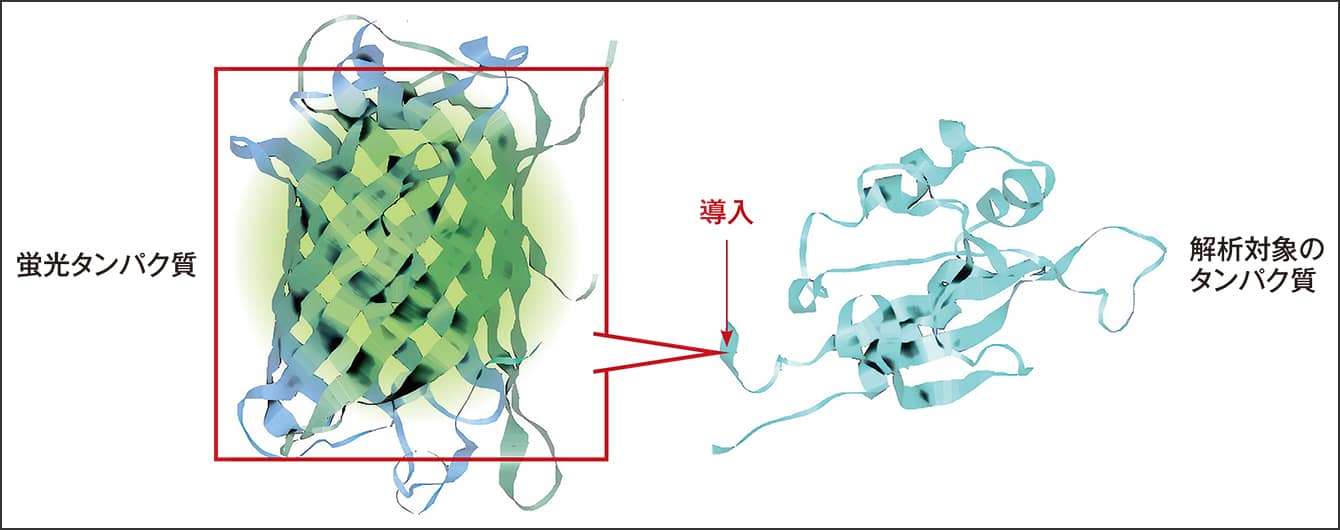
図1 蛍光タンパク質による可視化のイメージ蛍光を発するタンパク質であるGFPなどを細胞に導入すれば、その細胞を追うことができる。
導入したGFPを検出するのに、特定の光を照射するだけという簡便さもあって、この手法は生物学の研究において「使ったことのない人はいない」というほど広く普及することとなりました。
GFPに限らず、蛍光タンパク質は非常に優れたツールです。他の基質を必要とせず、細胞に毒性を示さないので、対象の細胞への影響がほとんどありません。今は当初のオワンクラゲだけでなく、ナメクジウオから採取した蛍光タンパク質も高い安定性がありますし、サンゴやイソギンチャク由来の蛍光タンパク質は、緑以外にも色の発現が可能で、染色できる色も増えています。色が豊富になったことで、核とA、Bという2つの分子の相互作用を観察したければ、核を青に、Aを赤に、Bを黄に、などそれぞれ違う色に染め、核の中にいるのか、外にあるのかなどの位置情報や、核への出入りといった時間の経過を観察することもできます。細胞の内部をカラーで観察できる時代になったというわけです。
ゲノム解析など、生体内の分子を網羅的に調べるオミックスは、安定した状態のたくさんの細胞の平均の状態を解析することを得意としています。それによって塩基配列が分かり、特に医療の分野には大きな貢献をしています。個人のゲノム情報に照らして適切な薬を選択できるなど、精度の高い医療を実現することとなりました。
生命の現場を知ることが求められている
他方、生体ライブイメージングという技術の重要な点は、時間の経過を見られることです。オミックスは細胞の一生の一瞬を切り取ったものなので、その次の瞬間に細胞がどのように振る舞うのかを知ることができません。生物学的な立場からすると、情報が足りないのです。しかも細胞には個性もあり、必ずしもすべてが同じように振る舞うわけでもありません。細胞の中の分子の増減や、状態の変化など個々の細胞の情報を追い、生命の現場を知ることがイメージングに求められているところです。
私たちの技術を用いて、生命現象を可視化したものに、飢餓状態の細胞性粘菌の振る舞いがあります。社会性アメーバといわれる土壌中の真核生物です。
図2は、飢餓状態の粘菌です。核を赤色に染めています。粘菌は通常、土壌中の細菌を栄養源としていますが、不足して飢餓状態になると、興味深い振る舞いをするようになります。10万個単位の細胞がワーッと中央に集まり、16時間程度たつとナメクジのような形になります。そして胞子を作って休眠するための「子実体」という最終構造を作るべく、良い場所を探し出します。
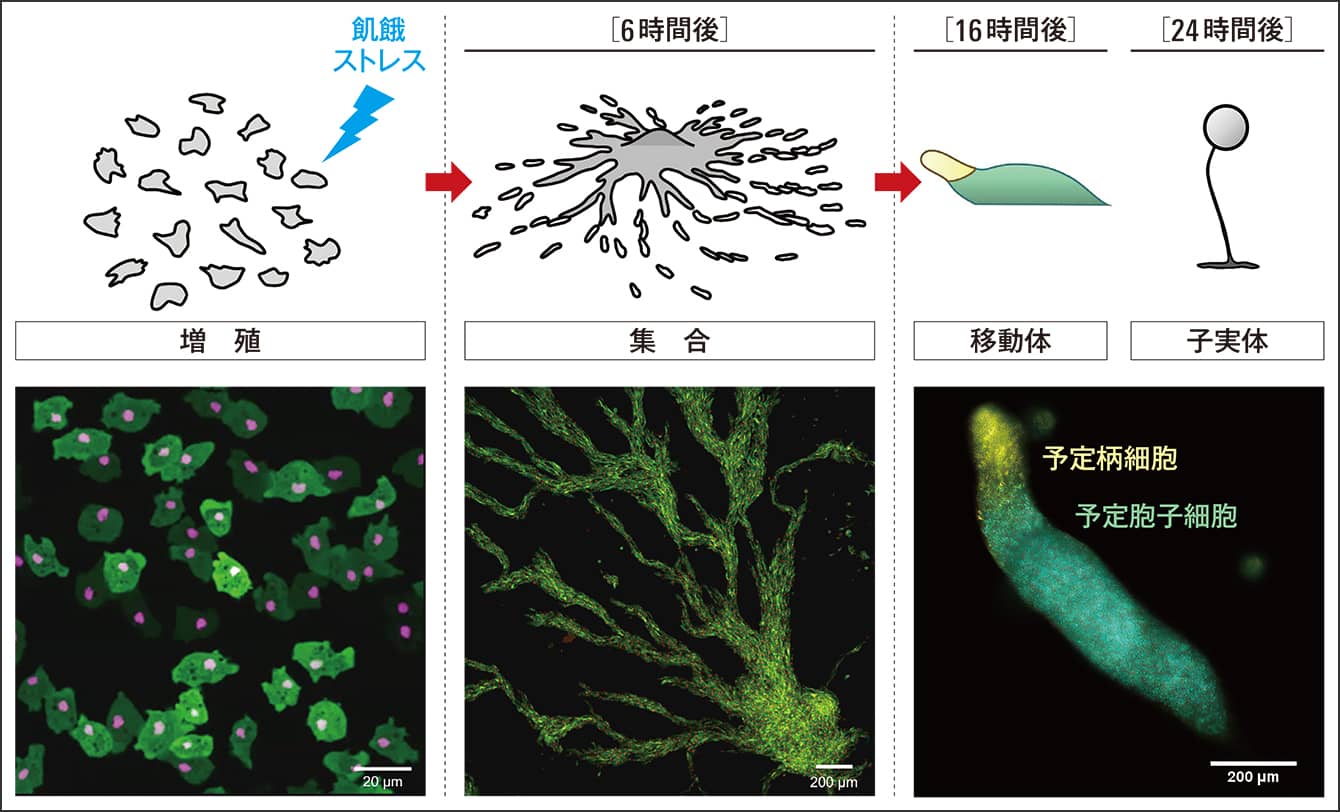
図2 飢餓状態の細胞性粘菌の振る舞い(連続写真)点在する赤い点はそれぞれの粘菌の核。それがどんどん1カ所に集まって、最後にナメクジのような形になる。
最初に、ある細胞が動き出し、それに同調して他の細胞が、渦を巻くようにして中央にどんどん集まり、すべてが集まったところで、形を作って他の場所に移動していくのです。
この一連の動きを観察できるようになっただけでも感嘆の声が上がりますが、生物学の研究室としては、そもそもアメーバ細胞が集団運動できるなどという不思議な現象がどのように起こるのか、という疑問も生まれます。
細胞が「集まる」という振る舞いは、細胞同士が接着することです。そこで、細胞の接着を促進する分子の転写(DNAの塩基配列を基にRNAが合成される)を観察することで、機序を解明しようとしました(図3)。
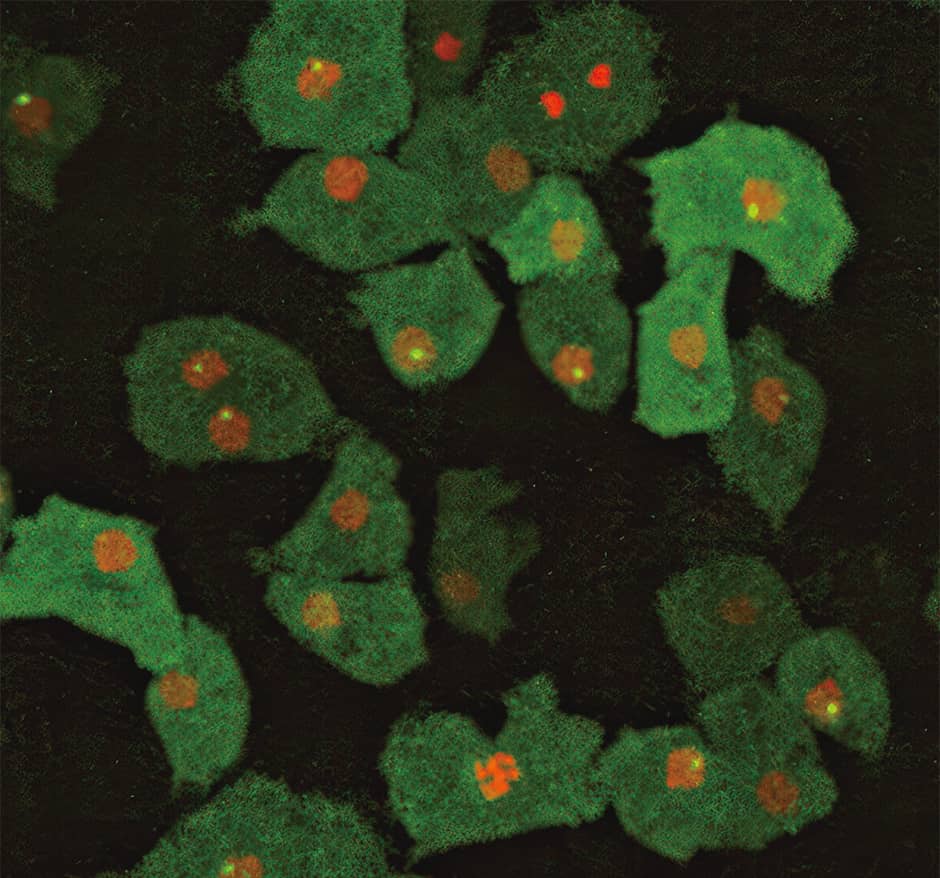
図3 mRNAの転写の様子核の中に赤の光が見えるときは転写が起こっているとき。赤の光が見えないときは転写が起こっていない。mRNAがたくさん作られて点がより明るいもの、mRNAが少なく暗いものなど、細胞によって転写の状態にはばらつきがある。
図の赤色で示した核の中に明るい点が見えます。これはDNAからメッセンジャーRNA(mRNA)が作られるとき、それを合成する酵素が働く瞬間を可視化したものです。DNAやmRNAといった核酸には蛍光分子が付着しておらず、それだけでは光りません。そこで、先の接着を促す分子を合成する情報を持つmRNAに、蛍光タンパク質を融合させた特殊なタンパク質が結合し、mRNAができた瞬間に細胞内で明るい点として可視化できるようにしました。動画を見ると、mRNAの転写の瞬間にポッと明るい点が現れては消えるという、転写がオンとオフを繰り返す様子を観察することできました。
mRNAに蛍光タンパク質を結合させ、転写のスポットを追うという作業はかなり時間を要する実験なのですが、mRNAの増減を本質的に議論するためには、合成されたタンパク質を見るのではなく、やはりmRNAを直接観察することが必須だろうと考えて、この手法を開発しました。
細胞の中で何が起こっているのか?
mRNAが合成されるのは、細胞が何らかのアクションを起こそうとするときです。この場合、擬人的に例えれば飢餓という状態を察した細胞が「集まって移動だ!」と号令をかけ、周囲の細胞がその声に応えて集合し、その集合の輪が広がり、一定の数が集まったら適当な形に整列して移動することだといえます。
mRNA合成を制御する分子を撮影した動画を見ると、細胞が集まる過程で活性化し始め、分子の振動が起こります。そして、その振動に同調して集団運動が起こることが分かりました。
さらに、私たちは、この分子の転写を操作することで、飢餓状態における粘菌の振る舞いをコントロールすることにも成功しています。
つまり、実際の動きを見ることで、なぜ単細胞生物があたかも脳を持っているかのように、同調して集団運動ができるのか、細胞の中で何が起こっているのかを理解する一端になったのです。
脳を持たない粘菌が、飢餓状態という危機に際して、決まったルールに沿って皆で集団運動していくという様子を実際に目にすると、生命の不思議に驚くばかりです。
転写の可視化は、DNAに貯蔵された遺伝情報が、RNAを介してタンパク質の構造や機能を規定している「セントラルドグマ」という現象を見たいという思いもあって行った研究ですが、それによってmRNAの転写が常にオンになっているのではなく、細胞によっても、また同じ細胞内でも、化学反応の周期が違うということが見えてきたのは、もう一つの成果です。
例えば、均一と思われていたがん細胞が、実は不均一だとする話題が最近よく聞かれます。確かに、私たちの研究での分子の転写の様子を見ても、均一ではないですし、図3のように、同じ遺伝子を持つ細胞内でもその遺伝子発現の頻度に明らかにばらつきがあるのが分かります。
単細胞の世界における、このような動きを見るにつけ、発想は多様に広がります。これを生態系に例えれば、細胞同士の相互作用は、さまざまな階層における個体の相互作用として見ることもできます。ある個体の情報に応えて、同じ方向を向くようになり、そして集団で勢いよく動き出すのです。人間の社会でも似たようなことがしばしば起きています。ある種、生物の原理を見たようにも感じられます。
私自身、生命の動きを見たいという思いは、ゲノムの解析だけでは生命を理解するための知見が足りないのだ、と知ったことがきっかけではありますが、ごく個人的な経験として、幼い頃、近所の河原で毎日のように生物の観察をしていたことも背景にあるでしょう。カニがハサミを振るのを見ていると、こんなにハサミを振るのはなぜだろう、と素朴な疑問が生まれました。私自身の研究のベースでもあり、またこれこそが生物学の基本なのだろうと思います。