私たちの記憶には、装置となるシナプスと、記憶の“部品”であるタンパク質分子が関与している。実はこのタンパク質分子、常に代謝されてかなり短い期間で入れ替わっているのだ。にもかかわらず、脳は数十年も記憶を保持することができる。まさに生命の奥深さに驚くほかないのだが、シナプスとタンパク質分子の間に、何らかの仕組みが存在するのではないかと考えられている。では実際、どのような仕組みなのか——その謎を解くには、記憶の「現場」を見ることが不可欠だという。
特集 進化する「視覚化」 なぜ記憶を保持できるのか? 脳の「現場」を見ることで解明
構成/飯塚りえ イラストレーション/小湊好治
私は分子の振る舞いを観察することで、脳の機能を支えるメカニズムを解明したいと考えています。
最初に、脳の大きな機能の一つである記憶のメカニズムについて、簡単に説明します。
例えば50歳の人に一番古い記憶は?と質問すると「3歳頃、お母さんと手をつないで歩いたことを覚えている」などと答えます。こうした記憶は、脳の海馬を介して大脳皮質に蓄えられています。
では、この人の大脳皮質は3歳のときからどのように変化しているでしょう。仮にコンピュータであれば、「覚えている」ということは、メモリーにデータが書き込まれていることで、ひょっとしたら50年間ハードディスクを取り替えることもなく同じ情報をずっと保持し続けることができるかもしれません。しかしヒトは違います。
どうして記憶を保持し続けられるのか
脳内で正常に働いているさまざまなタンパク質分子は、平均して十数日、短いものでは5日程度で入れ替わっています。ですから先ほどの、3歳の頃の記憶を最初に記録した分子は、50歳になったときには1分子も残っていません。つまり、私たちは、記憶の期間よりはるかに短い寿命の素子によって50年前の記憶をずっと保っているのです。
“部品”(分子)は常に変化しているのに、どうして記憶を保持し続けられるのでしょうか。
脳内の記憶のための装置は「シナプス」という構造(図1)です。情報を伝達する神経細胞間を接合しており、1㎛(1000分の1㎜)ほどの極小空間です。シナプス前方からグルタミン酸やGABAといったタンパク質分子が大量に放出され、神経伝達物質として機能しています。これをシナプス後方にある神経伝達物質受容体がキャッチします。
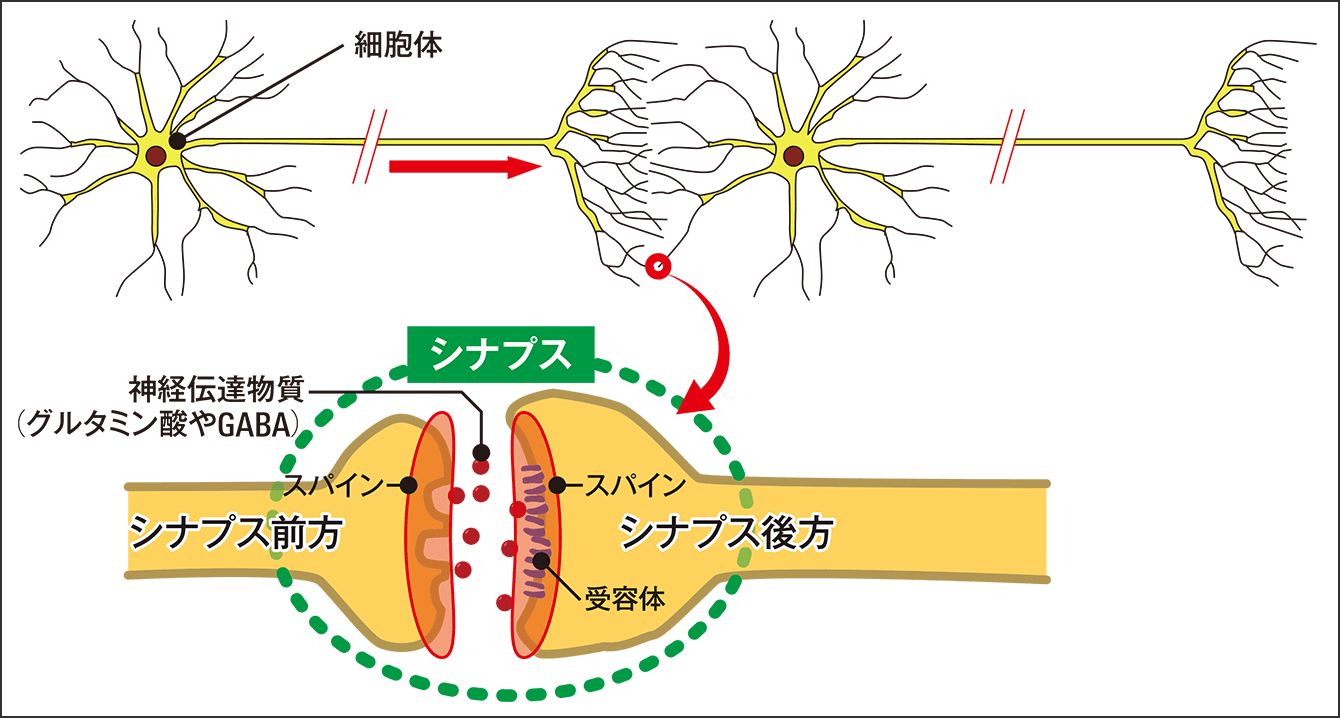
図1 シナプスの構造神経伝達信号の出力側と入力側の間にある空間構造。細胞体から長い軸索が伸び、その先にある空間構造がシナプス。出力側をシナプス前方、受容体側をシナプス後方という。
シナプス前方から放出される神経伝達物質を鍵と考えると、後方にある受容体はドアに例えられます。鍵を使うと、細胞に付いているドアが開くので、そこから細胞外液中にあったNa+やCa2+といったプラスのイオンが、どっと次の神経細胞に流れ込むのです。こうして次の細胞が「プラスイオンで満たされる」ことが、神経情報が伝わることの実体です。シナプス後方にあるドアは、多ければ多いほど、たくさんのプラスイオンが通るので、情報を強固に伝達することができます。
記憶が強く固定されるとは、つまりシナプスの機能が強くなることです。具体的には、シナプスにあるスパインという部分が物理的に大きくなること、受容体の数が多くあること、それに神経伝達物質の量が多いことが挙げられます。
記憶の現場であるシナプスで、受容体などさまざまな原料は常に入れ替わっているのに記憶が残っているのは、分子という部品の入れ替わり方に、何らかの仕組みがあるのではないかと考えられます。1カ月前の分子などまったく残っていないにもかかわらず、昨日と同じ人間として継続的に記憶を保って生きているという生命のシステムには驚くばかりなのです。
シナプスとタンパク質の「作用現場」を見る
そこで、記憶の現場を「見てみる」ことにしました。パリ高等師範学校のアントワーヌ・トリラー博士は、世界で初めて、シナプス後方の細胞膜に受容体が集積していることを、一つひとつの受容体に蛍光色素を付けて観察する「免疫蛍光染色法」を用いて観察しました。集まっている受容体の数が多ければ、蛍光色素の数も増えますので、より明るく見えます。さらに見やすくする細工を施して電子顕微鏡で観察すると、シナプス後膜に受容体が集まっていることが顕著だったのですが、では、なぜ細胞の縁である後膜に受容体が偏在しているのか、という疑問が生まれます。
さらに最近になって、シナプス前方と後方間の極小空間に、シナプスをつなぐ仕組みがあることが分かってきました。この仕組みが破綻すると神経伝達が行われません。実際、脊髄損傷やアルツハイマー病、小脳失調によって、記憶障害や、身体まひなどが起きているとき、この仕組みが破綻していることも報告されました。慶應義塾大学の柚﨑通介教授の研究室において、脊髄損傷モデルマウスにシナプス同士のつながりを強化するような人工分子を導入すると動かなかった後肢が動くようになったことが観察されています。
シナプスの細胞膜上でタンパク質や受容体がこぞって集合する場があることが分かりましたが、細胞膜は流体ですから、常に分子は流れています(図2)。ということは、一旦、分子が集合したとしてもずっとその場にとどまることはできません。加えて、分子の寿命は数日なので、変性してしまう可能性もありますから、どちらにしても新しい受容体とどんどん入れ変わっていくはずです。
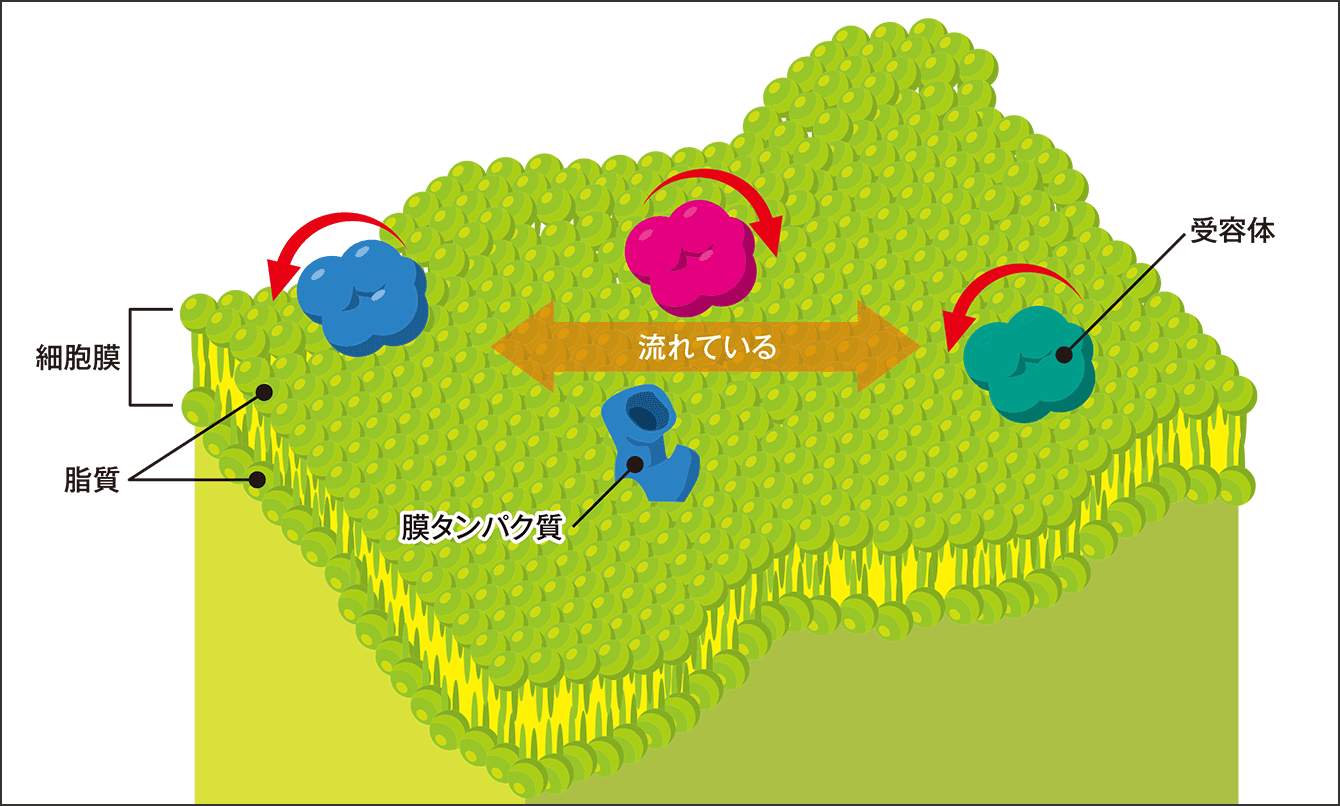
図2 細胞膜の様子細胞膜は脂質分子が二重になったような構造で、水を好む親水基が外側に、脂質を好む疎水基が内側に向いている。膜上は常に波打っており、受容体や膜タンパク質が緩やかに移動する。
膜上は非常に流動性があり、シナプスの受容体は常に50個程度がこの場にいますが、動いているのですから、とどまっている受容体はまったく同じではありません。言ってみれば、いつも人が行き交い混雑している、東京・渋谷のスクランブル交差点のイメージです。たくさんの人がいて、何かのイベントがあればもっと混み合う。しかし通る人はいつも違います。人の多少は、シナプスの強弱と考えればいいでしょう。大切なのは、そこに集まるということです。では、なぜ分子がこの場所にトラップされているのでしょうか。それを解明すべく、分子の振る舞いを観察してみました。
分子にマーカーを付けて動きを記録
分子の振る舞いを見るのは、探偵シャーロック・ホームズの推理のようなものです。ホームズは、助手のワトソンを観察して「君は今、こんなことを考えているね」と言い当てます。どうしてそんなことができるのかといえば、ワトソンの行動に情報が含まれているからです。同じように、分子の振る舞いにも意味があり、ある箇所で動きが遅くなったり、逆に動きがスムーズになったりしたら、そこにはこれまでとは違う条件があります。それが振る舞いを見ることの重要な意義です。
観察の手法としては、分子にマーカーを付けてその動きを記録しようという非常にシンプルなものです。この研究に着手した2005年当時としては、そのマーカーに量子ドットを用いた点は画期的だったでしょう。量子ドットとは、一辺が10nm以下の半導体結晶で、パソコンのディスプレイなどに使われます。当時、生体内を観察しようというとき、大きく2つの方法がありました。
一つは蛍光色素で染色して観察するという方法ですが、観察できる時間が短く当時は数秒でした。ですから同じ分子が入っていって出ていくという一連の動きをすべて観察することは困難でした。他に金属のタグを付けるという手法もありますが、こちらは細胞膜の間という極小空間には入っていかないので、やはり使えません。そこで、有効な時間が1分ほどと長く、また物理的にも小さい量子ドットは、分子の振る舞いを観察するのに大変使い勝手の良いツールでした。
受容体が集積している部分には、足場タンパク質といって、受容体と一瞬、結合できるような分子が多く集まっていました。この部分では受容体の動きが遅くなり、その結果、密度が高くなります。交通渋滞が起きているので、速度を下げざるを得なくなったのです。
シナプスがあるから受容体が集まるというのは、一見、当たり前のように思えますが、細胞膜が流体で動くことを加味すると、受容体は動きつつ、必要な箇所で速度が遅くなることが見えてきました。むしろ受容体がシナプスとがっちりと結合していたら、受容体の寿命は数日なので、そのシナプスは機能しなくなります。常にメンテナンスをしつつ、個体を維持する生命の仕組みの一端が見えたのです。
また、細胞内ではしばしばシグナルとして使われるカルシウムが受容体の動きを抑制していることを、自治医科大学の丹羽史尋助教が報告しています。細胞内シグナルを欠くマウスは、てんかんを起こして20日程度しか生きられませんが、このとき、ある種の受容体の動きが速くなっていることも分かりました。そのために、脳を正常に機能させるためのシグナルが伝達されず、破綻してしまうのです。
こうしてシナプスと分子の振る舞いを見ることで、病気の原因になるような1分子の挙動が解明されつつあります。
生命科学に新しい視点を与える
もう一つ、見ることによって脳の仕組みの解明に取り組んだのが、京都大学白眉センターの有薗美沙特定准教授が行ったグリア細胞の一つ、アストロサイトの研究です。
アストロサイトは脳血管の拡張・収縮、脳への栄養補給、時には直接、シナプスの伝達を制御することもあり、神経細胞の働きを補完するような役割を担っています。細胞体とその周辺に突起を持つ星形をしており、シナプスを覆って制御したり血管のへりにピタッとくっついたりと、複雑な形を取ります。
アストロサイト内では、なぜか突起部分にカルシウムシグナルが偏在していることが知られています。確かに、培養細胞でカルシウムシグナルを上げるような刺激を与えると、ほぼ100%の細胞で突起部分からカルシウム値が上がります。つまり、突起のほうが、カルシウム感度が高いのです。
この仕組みを調べるために、まずカルシウムの受容体がアストロサイトのどこにいるかを見てみました。細胞はつながっていて膜は流体ですから、受容体はどこにでも移動できるはずですが、実際に一定の数が観察できたのは突起の縁部分で、細胞体にはほとんどありませんでした。この結果を受けて、今度は1分子イメージングを行いました。1分子のカルシウムシグナルを起こす受容体に量子ドットを結合させて観察するというものです。10分程度の観察が可能だったのですが、結局、細胞体に入っていく分子はありませんでした。
突起の境界線では活発に動いているので、実験の状態では活動ができないということではありません。分子が10分間で動いた範囲を重ね合わせてみると、細胞体に入れていない部分にはきれいに空きがありました。突起でも入れる部分と入れない部分があって、分子の動きを見ると、細胞膜の中で区画化が起きていることが分かりました(図3)。
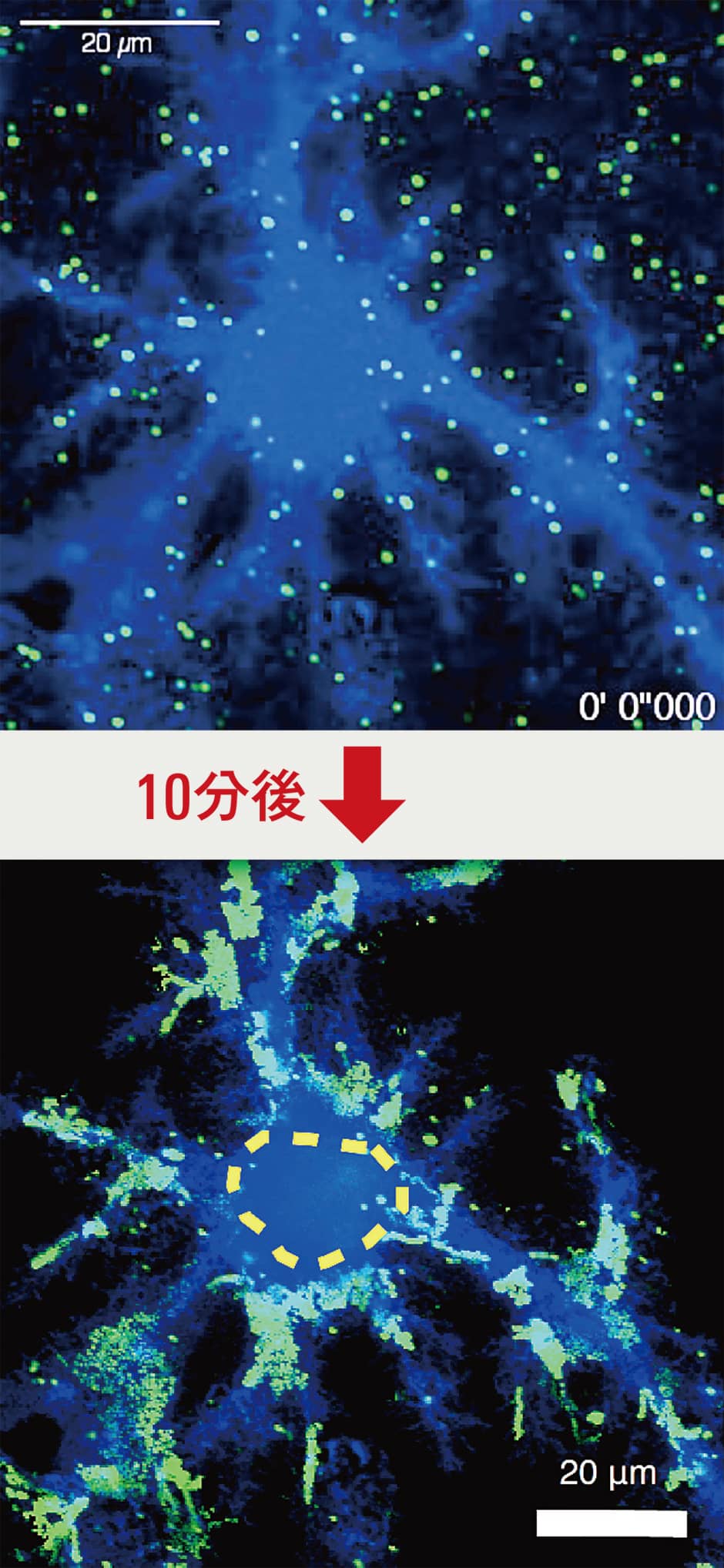
図3 アストロサイト細胞膜の区画化の例緑色に光る点が代謝型グルタミン酸受容体。アストロサイトにおいてカルシウムシグナルの引き金となる物質はグルタミン酸など。そのグルタミン酸を受容する代謝型グルタミン酸受容体を量子ドットでラベル(緑色)して動きを追跡したところ、黄色い点線で示した細胞体には緑色の光は見られなかった。このことから、代謝型グルタミン酸受容体の動きがアストロサイトの突起だけに限られることが示された。
さらに、この分子を細胞に大量に発現させたり、あるいは、この分子と細胞内の他のタンパク質との相互作用を阻害してみたりすると、カルシウムシグナルが突起だけでなく細胞体でも頻繁に起こるようになることが分かりました。突起が持つ、カルシウムシグナルをバリアする何らかの仕組みが破綻したと考えられます。こうなるとシナプスや血管の制御などに不具合が生じます。実は、アルツハイマー病の患者さんの脳では突起のバリアが破綻していることが知られています。
同じアストロサイト内でも、動きは一様ではないことが観察によって明らかになりました。情報には恐らく脳全体に広がるべきものと閉じた空間に限られるものとがあり、区画化がなされているようです。その区画のコントロールを支えている仕組みを少しずつ明らかにしていきたいと思っています。
生体内の分子を網羅的に調べるオミックスが簡単にできる中で、なぜあえて動きに注目するのかといえば、それが生命の現場で起きていることだからです。これまで述べてきたように、1つの細胞の中にはさまざまな場所があり、そのどこで起きているかや、そこで分子がどのように振る舞っているかが、生命活動において重要な意味を持ちます。そして、それを知るには実際に細胞を見るしかないのです。分子の振る舞いを見ることが、生命科学に改めて新しい視点を与えると考えています。