
1804年、江戸時代の医師・華岡青洲が「通仙散」を用いた全身麻酔手術を行った。西洋では1846年に、アメリカでウィリアム・モートンが行ったジエチルエーテルによる全身麻酔手術が初の成功例となる。しかし意外にも最近まで、なぜ麻酔薬が意識を失わせるのか、そのメカニズムは200年もの間解明されていなかった。2020年春、日本とアメリカで、全身麻酔の作用機序に関する2つの論文が相次いで発表された。
イラストレーション/北澤平祐

1804年、江戸時代の医師・華岡青洲が「通仙散」を用いた全身麻酔手術を行った。西洋では1846年に、アメリカでウィリアム・モートンが行ったジエチルエーテルによる全身麻酔手術が初の成功例となる。しかし意外にも最近まで、なぜ麻酔薬が意識を失わせるのか、そのメカニズムは200年もの間解明されていなかった。2020年春、日本とアメリカで、全身麻酔の作用機序に関する2つの論文が相次いで発表された。
人類に200年以上使われてきた麻酔薬に、いま注目が集まっている。
2020年7月、手術直後の患者の胸をなめたなどとして、準強制わいせつ罪に問われた医師の控訴審判決において、一審の無罪判決が破棄され、懲役2年の実刑が言い渡された。
本裁判の最大の争点のひとつは、原告が全身麻酔手術によって幻覚を見るなど意識障害を引き起こす「せん妄」だったかどうかである。
朝山芳史裁判長は、「女性の説明は具体的かつ詳細で、看護師らの証言とも整合する」と指摘し、せん妄であったという医師側の主張を否定。これに対し、日本医師会の中川俊男会長は「身体が震えるほどの怒りを覚えた」とし、今後も被告医師を支持する姿勢を表明した。
本件については意見も二分されており、未だ何が真実なのかはわからない。だが、一審の判決が覆されることからも、せん妄であるかどうかの判断は容易ではないということが明らかになった。
これまであまり深く考えてこなかったが、いったい麻酔とはどういう機序で成立しているのか。
実はその作用メカニズムには諸説あるが、なぜ人は意識を失うかについて根本的な分子細胞標的は解明なされてこなかった。つまり、どうして意識を失うかわからないまま、我々は麻酔を使い続けてきたのだ。
このように長年の謎だった麻酔薬の仕組みを解明した論文が今年になってようやく発表された。その鍵はシナプスだ。
「せん妄は、基本的には意識を司るシナプスのサーキットが正しく働いていないことによると考えられます」
沖縄科学技術大学院大学(OIST)細胞分子シナプス機能ユニットの高橋智幸教授はこう説明する。
高橋教授のグループは2020年4月24日、吸入麻酔薬の作用メカニズムを解明する研究結果を発表した。論文は「Journal of Neuroscience」にオンライン掲載された。高橋教授は東京大学大学院医学系研究科教授時代から、脳神経細胞シナプスの生理作用を専門としてきた研究者である。
今回、ラットの脳幹をスライスにしたものと、生きて覚醒しているマウスの大脳皮質のそれぞれについて、電気信号を記録する実験を行った。スライスは150ミクロンから200ミクロンほどの厚みであれば、神経細胞と神経回路が残っているという。その結果、シナプス前末端において高頻度刺激による伝達物質の放出量が減少することが、意識レベルの低下をもたらすと結論された。
その約1カ月後の5月28日、アメリカの研究グループによる「米国科学アカデミー紀要(PNAS)」に掲載された論文では、培養細胞を麻酔薬に浸して、超解像顕微鏡で観察した結果、麻酔薬が細胞膜の脂質クラスター構造を破壊して、神経信号のブロックに関わるカリウムチャネルを増強することが明らかになり、このチャネルを欠損させたハエは麻酔がかかりにくいことから、麻酔のメカニズムが判明したと話題となった。
これまで麻酔薬の仕組みがわからないまま、長年薬が使われてきたことに少し恐ろしい思いがすると尋ねると、高橋教授はそれはまったく見当違いだという。
「薬の歴史はそういうものです。使ってみて効いたから使い続けているわけで、本来、仕組みがわかってから使うというものではありませんでした。今、使われている有効な薬の多くは、薬草とか毒などの中から、良さそうなものを使ってみたことで発見されました。それを後世になって科学者が分析し、実はここに効いていたというメカニズムがわかってきたのです。
近代社会ではこれと逆に、機序を分析してから薬がつくられるようになりましたが、このような新薬が昔からの薬と比べて格段に優れているとは言えません。人間が新たにつくった薬は副作用が完全に明らかにされていない一方、昔からの薬は、副作用の強いものは淘汰されていて、比較的安全だとも言えます」
新しい薬は副作用に加え、効果が限定的だという問題もあるのだと指摘する。
「効果が限定的な薬も少なくありません。特に、アルツハイマー病などの神経の病気の薬はまだ効果が限られています」
今回、高橋教授が解明した麻酔薬によるシナプスの機能の変化は、実は麻酔薬に限らずに、さまざまな病気の治療にも応用できる可能性があるという。
脳の中には神経細胞がたくさんあって、回路をつくっている。そして神経細胞と神経細胞の間は離れていて、電気ではつながらない。そこを何がつなぐかというと、シナプスだ。シナプスは神経細胞と神経細胞のつなぎ役を担っている。
シナプスには前側と後側があり、前側から後側に信号が流れる。それを伝えるのが伝達物質である。シナプス前末端から伝達物質が放出され、この伝達物質が次の細胞に到達して、細胞膜のレセプターに結合し、再び電気信号が発生するという仕組みである。シナプスの働きというのは、一つの細胞の電気信号を他の細胞の電気信号に受け渡す役割で、だからスイッチに喩えられている。
「シナプスでは電気信号をオンオフしていますが、普段はオンのスイッチがオフに切り替わってしまうということもあります。シナプスはデリケートで複雑なシステムだからこそ、攻撃されやすい弱い場所です。システムがすべてうまく働かないと伝達できません。神経の病気として知られるアルツハイマー病やパーキンソン病、統合失調症やうつ病などではシナプスが正しく働かないことで、さまざまな症状が引き起こされると考えられます」
電気信号を担う活動電位は0.1ボルトのサイズで、速やかに神経回路を伝わるが、シナプスでは活動電位が発生する前に、伝達物質がもっと小さな電位的変化を起こす。伝達物質がレセプターにくっつくと、電気的なシグナルが生じる。電気的シグナルは小さいが、それがあるレベルの発火点に到達するともっと大きな、いわゆる活動電位が発生する。二段構えのロケットみたいなもので、最初のものはシナプス電位、後のものは活動電位と呼んで区別する。
ゆえに、シナプス電位が小さくて発火点に届かないと、活動電位が発生しない。そうすると神経回路はつながらない。
「活動電位が発生するにあたって、もともとの細胞膜電位のベースラインが下がっていると、シナプス電位が発火点に到達しにくくなります。このベースラインを下げるというメカニズムで活動電位の発生をブロックするというのが、先に述べたPNASの論文の主旨です」
麻酔薬による細胞膜脂質の構造変化がカリウムチャネルに作用してベースラインを下げることを見つけたところがこの論文の新規性だと高橋教授は言う。
高橋教授らは、麻酔薬がシナプスのどのようなメカニズムに作用するかについて研究を行った。
「麻酔薬が脳のシナプスに効くことは間違いのないことでしたが、シナプスのどういう標的に作用するのかがわかっていませんでした。今回私たちは、伝達物質の放出メカニズムに麻酔薬の標的があることを解明しました」
脳は神経細胞の枝がシナプスを介して織りなす回路によってできていて、麻酔薬によってシナプス伝達が遮断されると意識や痛みがなくなる。
「私たちの研究では、何が第1標的かを調べるために、普段手術で使われる濃度の麻酔薬によって、最初に遮断されるのはどこかを調べました。まずはラットの脳の一部分を150ミクロンくらいのスライスに切り取って、シナプスと神経回路が残っている状態で実験します。さらに、覚醒しているマウスに麻酔をかける前後で、大脳皮質のシナプスを介して生じる活動電位がどのように変化するかを調べ、スライスの結果と突き合わせ、共通点を探索しました。そこで得られたいちばん重要な結論は、麻酔薬は高頻度のシナプス伝達を選択的にブロックするということです」
脳波はシナプス電位と活動電位の時間的、空間的総和である。脳波の高周波成分は認知、記憶、運動制御、意識などの高次の脳機能に関わり、低周波成分は生命の維持に欠かせない。目が覚めていると細かい波が出て、うつらうつらすると脳波がゆっくりになることはよく知られている。
「シナプスを刺激して、シナプス電位によって活動電位が発生するようにしておき、麻酔薬をかけると、最初に高頻度の脳波がブロックされました。高頻度の脳波は意識などに関わっている部分です。つまり、麻酔薬は低頻度信号を通し、高頻度信号をブロックするローパスフィルターの役割をしています。麻酔薬は生命の維持に必要な低周波信号を温存しつつ、意識を支える高周波信号をカットして、麻酔を引き起こすと考えられます」
つまり麻酔薬は命を確保しながら、高次機能だけ抑えていることになる。だが、濃度を上げていくと、徐々に低頻度の活動電位もブロックされ、最終的には死に至る。
これらの実験と並んで、スライスの実験から、麻酔薬はシナプス前末端に作用して伝達物質の放出を阻害することがわかったという。だが、シナプス前末端のどこに作用するものなのだろうか。
「我々が発見したターゲットは2つです。伝達物質はシナプス小胞という袋状の膜組織中にあります。この小胞内には数千分子の伝達物質が濃縮されています。小胞の膜はカルシウムイオンの働きで神経末端の膜と融合すると、くす玉割りみたいにぱかっと穴が開いて伝達物質が放出されます。
吸入麻酔薬の第1標的はこの開口放出に関わるタンパク質、第2標的は細胞内にカルシウムイオンを流入させるチャネルであることがわかりました。高頻度のシナプス伝達では、麻酔薬はこの両方の標的をブロックして活動電位の発生を抑える一方、低頻度のシナプス伝達に対しては専ら第2標的のカルシウムチャネルだけを抑制するため、活動電位のブロックに至らないことがわかりました」
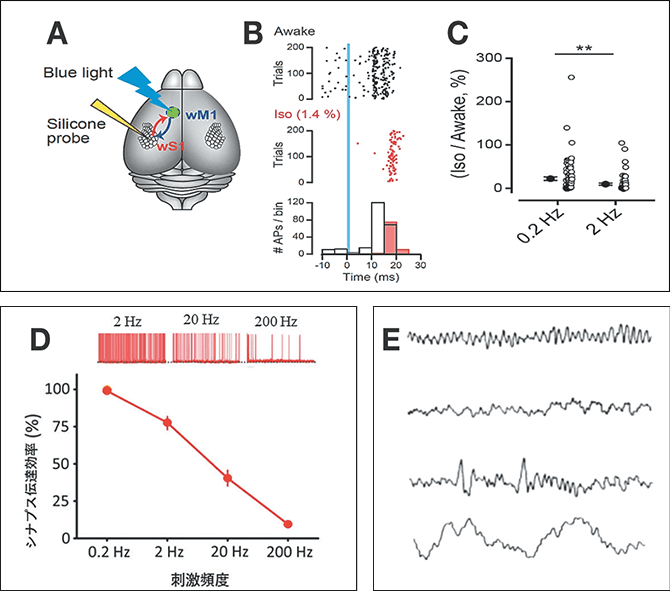
(A-C) 頭部を固定したマウスの大脳皮質第5層の32カ所に記録電極を置いて、約150個のニューロンから活動電位の発火を記録した。麻酔薬吸入後、高周波の活動電位発火は減少し、選択的にブロックされる。(D)脳幹スライスの単一シナプスにおける伝達。麻酔薬投与後、前シナプス高頻度刺激による後シナプス細胞の活動電位の発火が選択的にブロックされる。(E)は意識レベルの低下(上段→下段)に伴う脳波の変化。(図版提供:高橋智幸)
これらの成果は麻酔薬の臨床に直ちに役立つものではないが、薬物のシナプスにおけるターゲットを明らかにするための方法論を確立することは、基礎、臨床を通じて非常に重要な意味を持つと高橋教授は考えている。
「ターゲットがわかることの重要性は、麻酔にとどまらず、すべての薬物、すべての病気について言えます。今回の麻酔薬の研究は、シナプスの機能が損なわれるメカニズムの一端を明らかにしたもので、神経疾患の治療薬を探索する上の基礎固めになると考えます。例えば、現在、私たちが研究中のα-シヌクレインというタンパク質は、シナプス前末端で異常に増えることによってパーキンソン病を引き起こすことがわかっています。問題は、このタンパク質の標的が何かということです」
それを探索するために、高橋教授らはシナプス前末端に外からα-シヌクレインを故意に注入して、シナプスの動作の変化を観察して、その原因を探った。シナプス小胞は、伝達物質を放出するといったん空になる。それをもう一度回収し、その中に伝達物質を詰めるというリサイクリングを繰り返している。α-シヌクレインが増えると、このリサイクリングがブロックされて、伝達物質の補給が損なわれる結果、特に高頻度のシナプスの伝達効率が低下するという。この結果は、2017年の「Journal of Neuroscience」に掲載された。
「シナプス伝達が損なわれると、感覚も運動能力も衰えていきます。この研究はどうやったらそれを回復できるのかを探る第一歩です。スライスの実験では、小胞の補給を回復させる薬物が見つかりました。今後はより人に近いモデルでテストを行い、最終的には治療薬につなげたいと思っています」
高橋教授は、これらの基礎研究が、シナプス機能の観点からの創薬や、あるいは昔からある薬の効果の再発見につながるかもしれないとも考えている。
「今後はシナプスの生理学の立場から、統合失調症や双極性障害などの研究にも、手を伸ばしたいと思っています。世界にはシナプスの生理学やメカニズムを研究している人はたくさんいて、ノーベル賞を受けている人もいますが、これまではその研究成果が神経疾患の治療につながることはあまりありませんでした。今後、シナプス生理学の研究成果が、治療につながるようになることを願っています」
高橋教授は1944年生まれの76歳。東大を退官後、同志社大学を経て、今も第一線で研究している。沖縄科学技術大学院大学は基本的には70歳が定年だが、例外を認めるということで、厳しい外部審査を受けて5年契約で延長し、さらに今年3年の延長が決まった。
「ずっと好きなことをやり続けることができて、私はとても幸運でした。残された時間はあと少しですが、まだ解明したいことがたくさんあります。経験を積むことで、これまでできなかった解析が可能になってきました」
どうして200年も解明できなかった仕組みの一端を明らかにできたのだろうか。
「実は、新しい発見はすごく大きなジャンプからというよりは、今までの経験が多くの知見と組み合わさって生じたアイデアによって導かれるのだと思います。自分の経験は、そのための重要な素材です」
麻酔薬に限らず、脳も、人間自体の仕組みもまだまだわからないことのほうがずっと多いという。未知だった事柄を解明した研究者の話を聞くことで、相反するようだが、メカニズムが解明されることで救える命があることへの大きな期待を持った一方、わからないものがあることは問題ではなく当たり前のことなのだということにも気づかされた。