現在は新しいタイプのワクチンが登場し、従来と比較すると格段のスピードで予防接種が進んでいる。しかし、新たなパンデミックやバイオテロを考慮すると、さらなる即応性は不可欠だろう。核酸のプラットフォームを基盤としたモックアップワクチンをあらかじめつくっておけば、病原体に応じて抗原などをモジュール化して組み込むことで、最適なワクチンを迅速に生産できるという。
特集 ワクチンの軌跡より迅速で最適な接種へ! 進化するワクチンの近未来
構成/河﨑貴一
予防ワクチンは、過去、現在を含めて、もっとも成功した医療技術のひとつです。私たちに感染症を起こす病原体には、寄生虫や原虫(真核単細胞の微生物)、真菌(カビ)、細菌、ウイルスなどがあります。今回、問題になっている新型コロナウイルスは、風邪やSARS(重症急性呼吸器症候群)、MERS(中東呼吸器症候群)などコロナウイルスの仲間です。この新型コロナウイルスによるパンデミックは、「ワクチンの研究の重要性と緊急性」を改めて浮き彫りにしました。
ヒトを含めた脊椎動物には、病原体に対して3つの防御機能が備わっています。その3つとは ——
1)物理的な防御(皮膚や粘液など)
2)自然免疫(貪食細胞や補体が病原体などを破壊)
3)獲得免疫(抗体や白血球の一種のT細胞が働いて病原体を破壊)
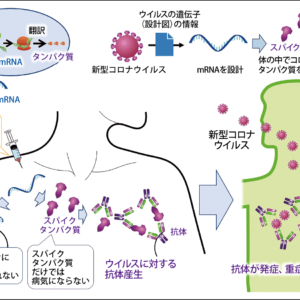
ワクチンは、獲得免疫の機能を活用して、ウイルスや細菌などの病原体の特徴を抗体として体に記憶させるために接種します。ワクチンを接種すると、その病原体が体に侵入したときに免疫反応が起きて、感染や重症化を防ぐことができます。
現在はさまざまな種類のワクチンがある
ワクチンといえば、18世紀末、天然痘の予防接種を行ったエドワード・ジェンナー(英国人医師)が知られています。そのジェンナーより早く、古代中国や古代インド、古代ローマ、17~18世紀のオスマン帝国でも、天然痘にかかったヒトの瘡蓋を赤ちゃんの足に埋め込んだり、鼻から吸わせるなどの人痘(バリオレーション)が行われていました。
「ワクチンは、病原菌を弱毒化するんですよね」とおっしゃる方がいます。弱毒化ワクチンは、今から200年以上前の話です。現在のワクチンには、ウイルスベクター、mRNA(メッセンジャーRNA)、DNA、組み換えタンパク、不活化、その他の種類があります(図1)。
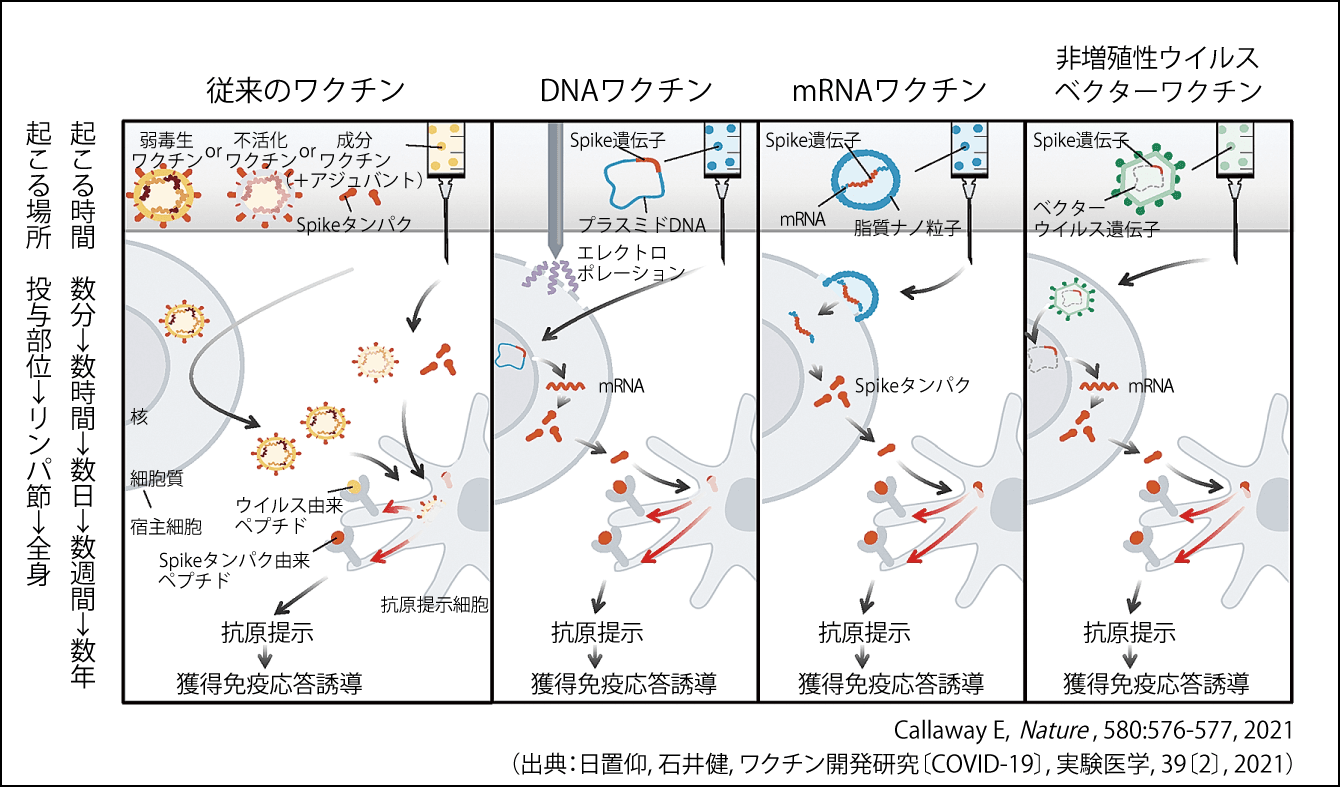
図1 主なCOVID-19ワクチンの作用機序新型コロナウイルスに、従来のワクチン、DNAワクチン、mRNAワクチン、ウイルスベクターワクチンが作用する仕組み。ウイルスのスパイクタンパク由来のペプチドを、免疫細胞に抗原として認識させるのが目的。
従来のワクチン
従来の弱毒生ワクチン、不活化ワクチンは、成分ワクチンを接種すると、細胞に取り込まれて、細胞の中でウイルスが増えます。その細胞から出てきたウイルス由来のペプチド(アミノ酸が2~49個つながった分子)を、B細胞やT細胞の抗原提示細胞が「異物が来たぞ」と認知して獲得免疫応答が起こります。ワクチンの効果は、接種後数週間から数年続くと考えられます。
DNAワクチン
コロナウイルスのまわりには脂質膜に突き刺さるような形で王冠(コロナ)様の突起(スパイク)がありますが、そのスパイクの遺伝子をプラスミドという所に組み込んだのがDNAワクチンです。接種すると、このプラスミドが細胞の核に行き、スパイクタンパクのDNAからmRNAに転写されてタンパクに翻訳されます。そのタンパクが抗原提示細胞に取り込まれて、抗原提示するというふうに考えています。
mRNAワクチン
mRNAワクチンは、ウイルスのスパイクの遺伝子を組み込んだDNAによって転写されて出てきたmRNAを、そのまま脂質ナノ粒子にくるんだものです。このmRNAが細胞に入ると、核には行かずに、細胞質でスパイクタンパクをつくって、あとはDNAワクチンのときと同じように、抗原提示と獲得免疫応答誘導が起きます。このように、mRNAワクチンはDNAワクチンに比べて、ひとつのステップをスキップ(短縮)します。
mRNAワクチンには、壊れやすい成分が含まれているので、マイナス70℃前後という超低温での保管が必要になります。
ウイルスベクターワクチン
「ベクター」とは病原体の媒介動物の意味で、ほかのウイルスを“借家”にして、ウイルスのスパイク遺伝子を入れたのがウイルスベクターワクチンです。この弱いウイルスは、感染したあとで、核にDNAを吐き出して、それをもとに転写されたmRNAがペプチドをつくります。そのペプチドに対して抗原提示され、獲得免疫誘導が起きます。
ただし、借家にしているウイルスに対して、もともと免疫がある場合には、DNAワクチンやmRNAワクチンとは全然違う免疫が起きる場合もあります。
強い免疫誘導能力が実感できる
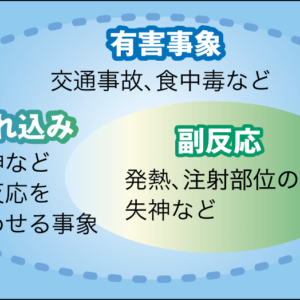
これらのワクチンは、腕の筋肉細胞に打ちます。接種場所は腫れたり赤くなったりしますが、これらは自然免疫の炎症や組織修復で、免疫反応ではありません。ワクチンの本来の効果である抗原特異的免疫反応は、接種場所から離れたリンパ節で起こります(図2)。
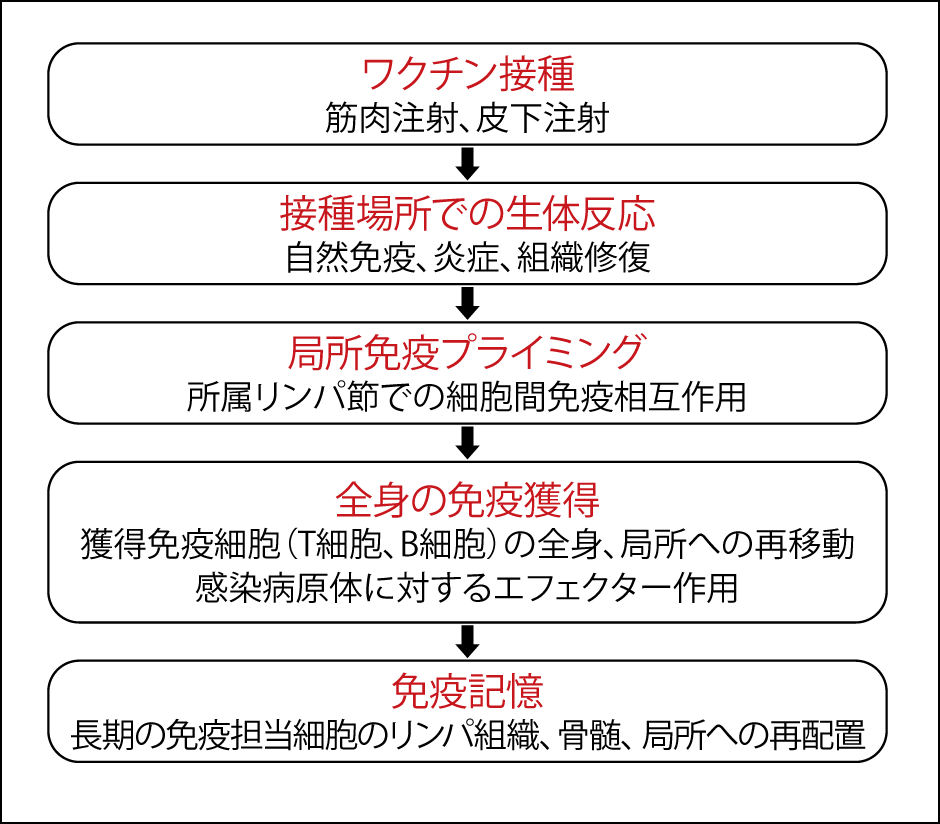
図2 ワクチンによる免疫獲得の経過筋肉注射されたワクチンは、リンパ節で抗原特異的免疫反応が起こり、抗体が全身にまわって、長期間免疫の効果が持続する。
その後、抗体は全身にまわって長期間免疫の効果が続きます。しかし、どうやってT細胞やB細胞が全身にまわって、いろいろな病原体に対して攻撃の用意をするのか。骨髄なのか、局所なのか。免疫については、まだまだわかっていないことだらけです。
日本政府は、新型コロナウイルスのワクチンとして、米ファイザー/独ビオンテック社のmRNAワクチンを承認して2月から接種が始まっています。5月からは、米モデルナ社のmRNAワクチンと英アストラゼネカ社のウイルスベクターワクチンの接種も始まる予定です。
では、これらのワクチンにはどのような違いがあるのでしょうか。
生産速度は、生ワクチンや不活化ワクチンでは、鶏卵や動物の細胞を使うので、つくるのに半年ほどの時間がかかります。それに対して、DNAワクチンやmRNAワクチンは、ものすごく早く、大量につくることが可能です。
免疫誘導能力、つまりワクチンの効果は、生ワクチンはもっぱら病気のウイルスをまねているので、非常にいいのですが、安全性については「0」にはなりません。
不活化ワクチンとDNAワクチン、mRNAワクチンの免疫誘導能力については、それぞれ千差万別です。その中でもmRNAワクチンは、今までにないほど強い免疫を起こすと実感できるワクチンです。
安全性については、DNAワクチンの安全性は確立されてきましたが、mRNAワクチンは接種されるのが今回初めてで、安全性についての保証がない国のワクチンもあるので、まだ「?」の部分があります。
核酸のプラットフォームを基盤とした開発
私自身は、1996年、米国保健福祉省食品医薬品局(FDA)や生物製剤評価研究センター(CBER)に客員研究員として留学し、DNAワクチンやアジュバント(ワクチンの効果を高める物質)の開発に携わりました。また、それらを臨床試験審査官として審査する機会にも恵まれました。
2003年に帰国し、2010年からは医薬基盤研究所(現・医薬基盤・健康・栄養研究所)でMERSのmRNAワクチンをつくり、SARSのワクチン開発に携わりました。その前後には、新たにできたDNAワクチンやアジュバントの開発、研究にも携わりました。2006年からは、大阪大学で、DNAワクチンのメカニズムを解明しました。
それらのワクチン開発の経験と、留学中に「9・11アメリカ同時多発テロ事件」(2001年)を体験したことなどから、バイオテロや人工的な感染症のアウトブレイク(突発的発生)に対して、すぐに生産できて、対応できるワクチンの必要性を痛感し、開発を続けてきました。
そして、2016年、緊急感染症対策として、核酸のワクチンプラットフォーム(DNAやmRNA)と核酸のアジュバントを基盤にして、迅速なワクチンを開発する事業を、医薬基盤・健康・栄養研究所の霊長類医科学研究センターの保富康宏センター長や企業との共同研究で開始し、モックアップワクチンプロジェクトを立ちあげました。「モックアップ」とは、模擬という意味です。
この事業は、2018年、残念ながら国から臨床試験の予算はカットされて凍結されました。しかし、翌年、私が東京大学医科学研究所に移ってからは、研究を再開し、現在は同研究所の河岡義裕教授や四柳宏教授とともに、「新型コロナウイルス(2019-nCoV)の制圧に向けての基盤研究」を始めました。
ワクチンをつくろうとすれば、数十人から数百人のワクチン研究者を含めた開発スタッフと、10年から20年の時間、多い場合10万人もの治験参加者、1000億円以上の予算が必要です。今回、米国や英国、中国などで1年以内にワクチンが開発されたのは、1兆円もの予算が投入されて、前臨床試験、臨床試験、第1相、第2相、第3相を並列に進行できたからです(図3)。それに対して、日本がワクチン開発に拠出すると決めたのは100億円と、欧米諸国の開発費用の100分の1程度でした。開発スタッフも、新型コロナウイルス感染症の問題で、集まることができませんでした。
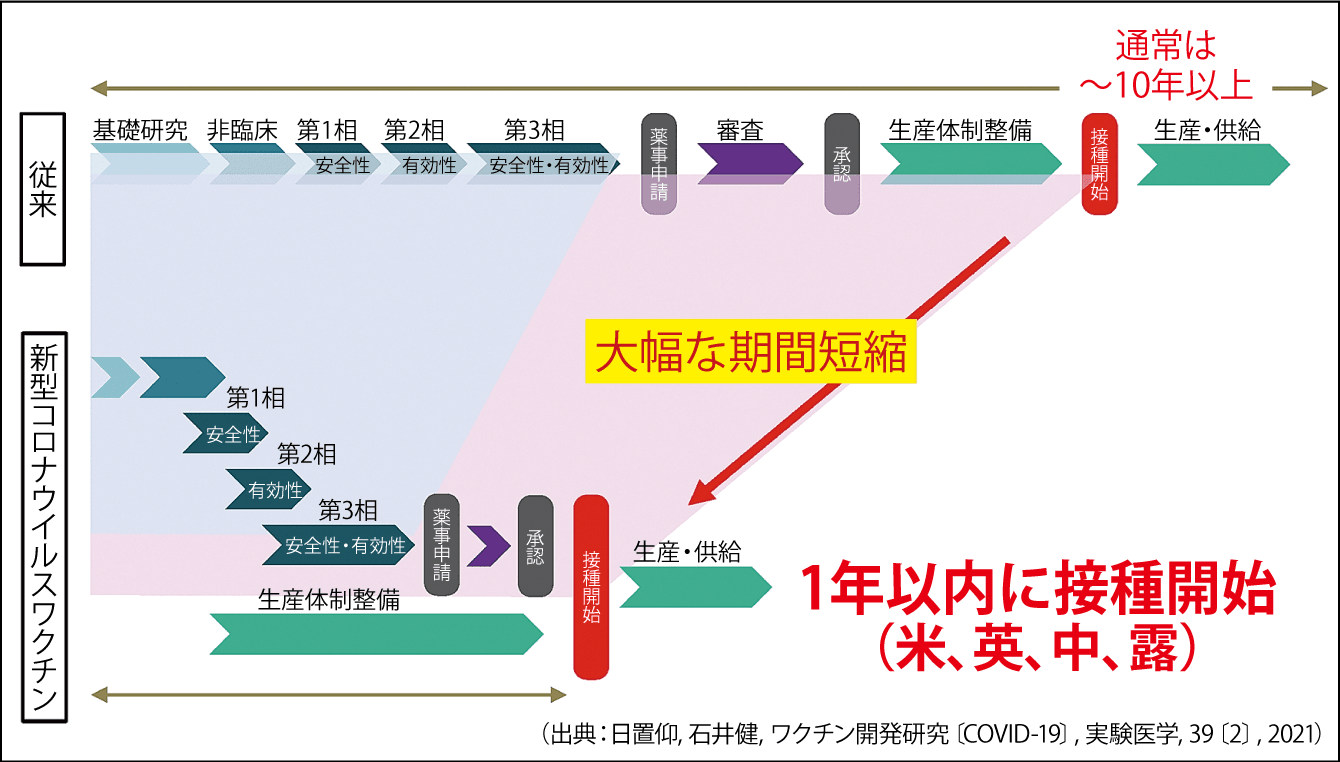
図3 COVID-19ワクチン開発スケジュールワクチンは、基礎研究から多くの試験を直列で行うので、10年以上の期間と莫大な費用がかかる。今回の米・英・中各国は、1兆円もの試験費用をかけて、試験を並列に行ったので1年以内に接種を開始できた。
新型コロナウイルスのワクチンを私たちが開発していることに対して、「欧米より周回遅れで開発する意味があるのか」とおっしゃる方もいます。しかし、日本の医薬品には、特にアジア諸国から「安全・安心」というブランドがあります。「日本製のワクチンが完成すれば、私たちは輸入して接種する」というアジアの友人たちもいます。
それに、ワクチン開発は、外交、国防、経済・産業に大きく影響し、最終的には市民の安全につながる公衆衛生・市民安全の要です。
私自身は、ワクチンを構成する抗原、アジュバント、生体内デリバリーを自動車のパーツのように別々に用意し、モジュール化して、病原体ごとに組み合わせるようなワクチンが、即応性があっていいのではないかと思っています。これらのパーツを組み込むモックアップワクチンをつくっておくのです(図4)。
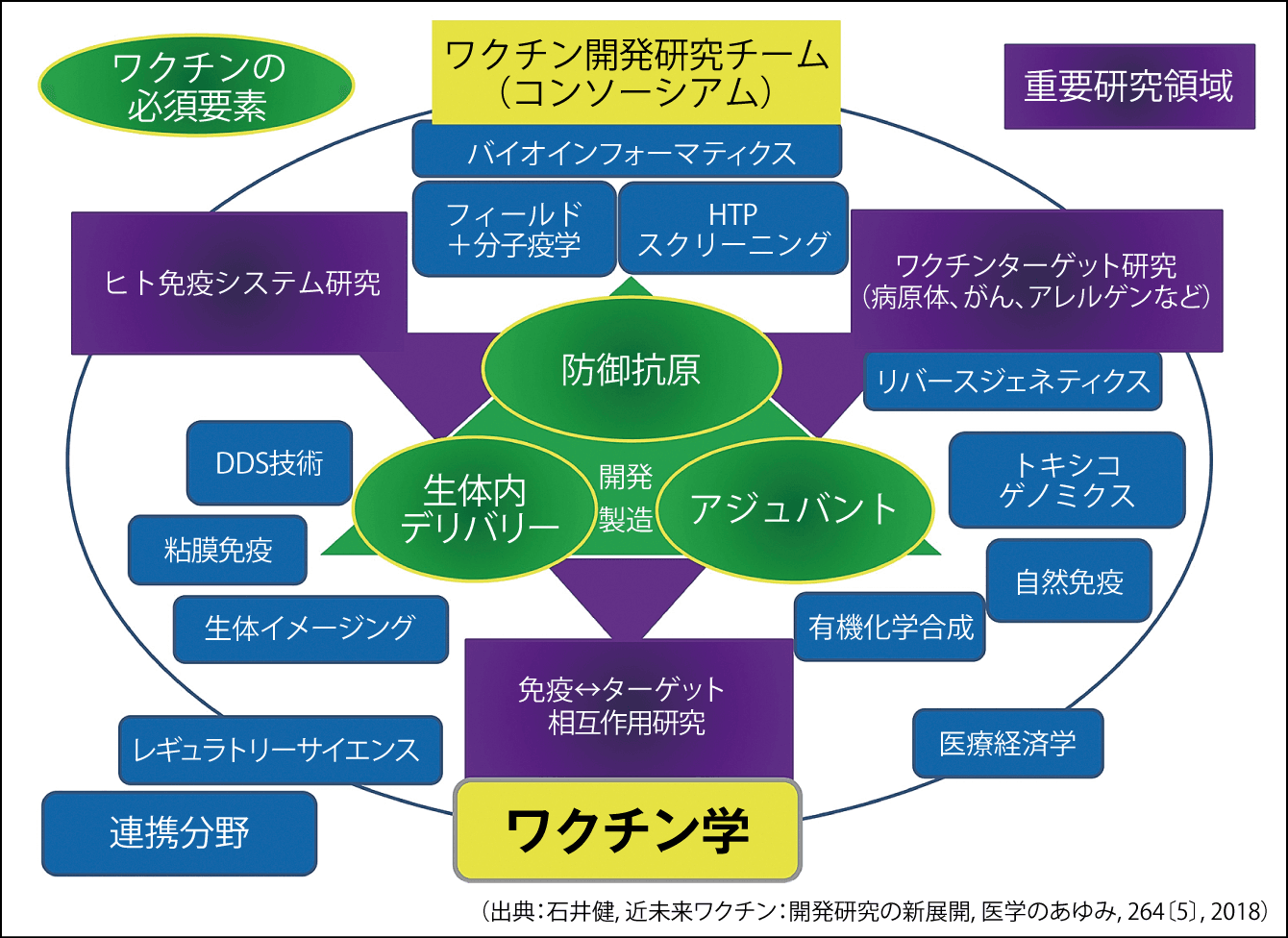
図4 新規ワクチン開発研究のイメージワクチン開発は、抗原とアジュバント、生体内デリバリーの専門チームに、科学技術の結集が必要。抗原とアジュバント、生体内デリバリーをモジュール化して組み合わせると、効率的なワクチン開発が可能になる。
モックアップワクチンには大きなメリットがあります。
1)どの感染症がいつ発生するのかわからない場合でも、モックアップ抗原といくつかのアジュバントを組み合わせたモックアップワクチンをつくっておけば、すぐに最適なワクチンをつくることができます。新型コロナウイルス以外の感染症にも対応が可能です。
2)病原体の抗原の塩基配列やアミノ酸配列がわかれば、DNAやmRNAを文字どおり一晩でつくることができます。
3)DNAやmRNAの核酸があれば、全国にたくさんの小さなワクチン生産工場をつくれます。大きな製造タンクは必要なく、小さな規模でも生産可能ですから、感染症に対して迅速に対応できます。
モックアップワクチンの実験はすでに終わっています。実験では、非常にいい結果が出ています。ヒトの免疫活性も、試験管では確認済みです。特許も出願済みで、論文もすでに準備できています。
私たちは、2021年度中に企業治験第1相を開始する予定です。