感染症の切り札とされるワクチンは、開発から供給まで15年以上はかかるといわれてきたが、COVID-19(新型コロナウイルス感染症)ワクチンは1年ほどで実用化に至った。これは全く新しいタイプのワクチンによるもので、mRNA医薬の成果だ。さらにmRNA医薬の治療領域は感染症だけにはとどまらず、がんワクチンや抗体医薬をはじめ、多岐にわたる。mRNAワクチンの登場で、mRNA医薬の研究開発が加速する。
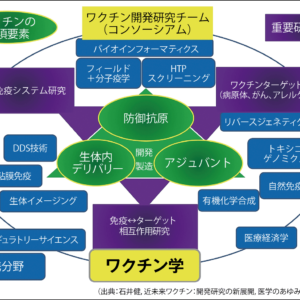
特集 ワクチンの軌跡 COVID-19ワクチン実用化で加速するmRNA医薬の開発
構成/大内ゆみ
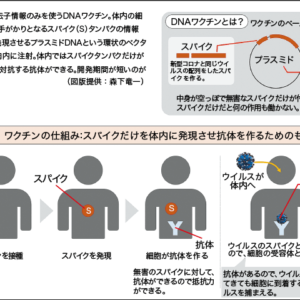
現在、日本で接種が進んでいる新型コロナウイルス感染症のワクチンは、メッセンジャーRNA(mRNA)ワクチンというタイプのものです(図1)。3月時点で、米ファイザー/独ビオンテック社製、米モデルナ社製のmRNAワクチンが実用化に至っています(日本ではファイザー/ビオンテック社製)。このmRNAワクチンは、これまでの感染症ワクチンのようにウイルスや細菌を弱毒化、もしくは感染力を失わせた(不活化)ものではなく、全く新しいタイプのワクチンです。
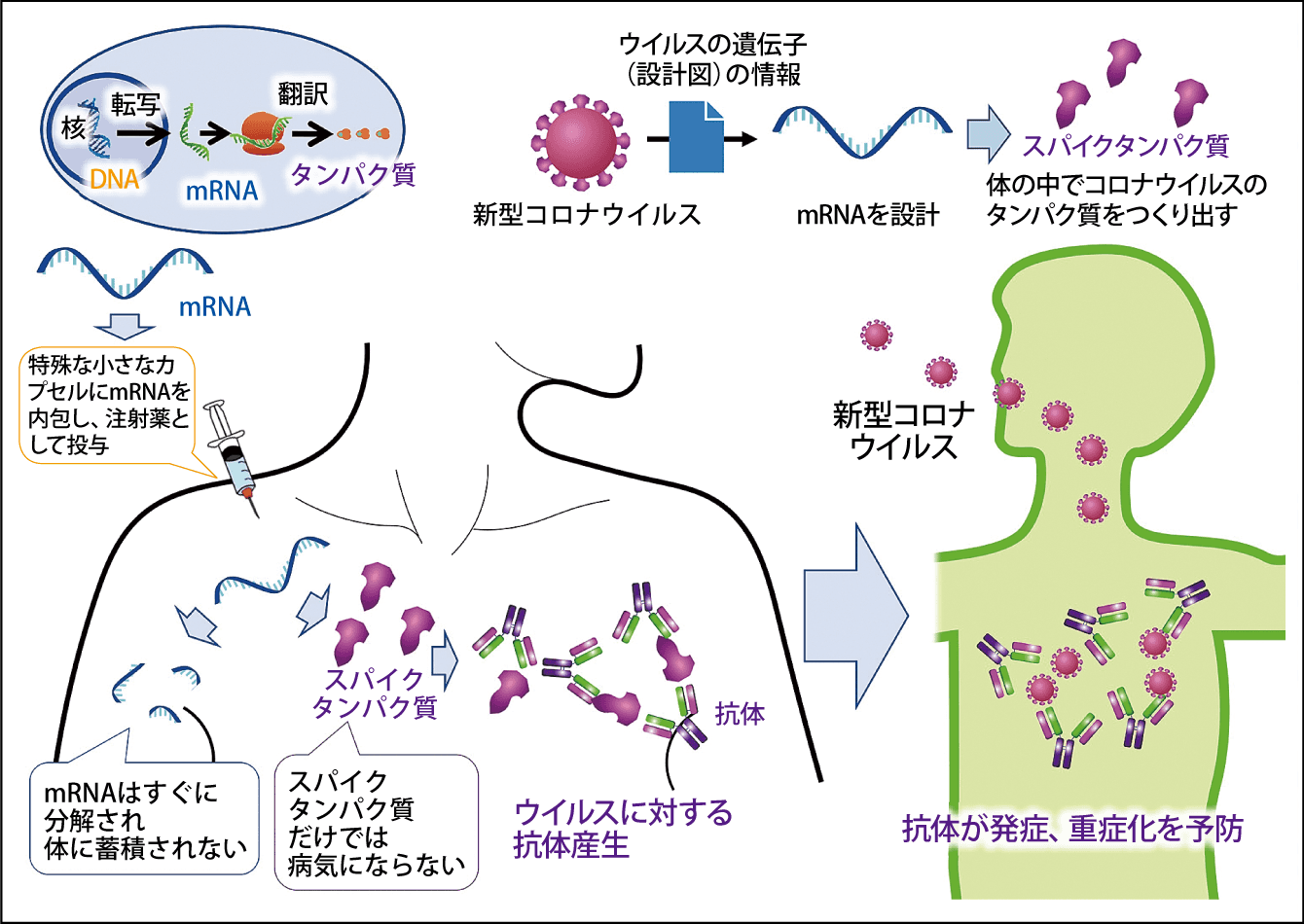
図1 mRNAワクチンの仕組みウイルスの遺伝子情報をもとに設計したmRNAを体内に投与すると、免疫機構が働き、ウイルスに対する抗体が産生される。ウイルスそのものを投与せず、mRNAとスパイクタンパク質も体内に残らない。
mRNAは、体内の細胞核内に存在するDNAの遺伝子情報が転写されたRNAで、細胞核から出てタンパク質を産生するために必要な情報を伝えるという、まさに遺伝子のメッセンジャー的な役割を果たしています。このmRNAの機能に注目し、体の外から特定のmRNAを投与して、人工的にタンパク質をつくり、疾患の治療を行うmRNA医薬の開発が1990年ごろから進められてきました。
mRNAワクチンもその一つで、世界で初めて実用化に至ったmRNA医薬です。すでにインフルエンザ、ジカ熱のワクチンの臨床試験が行われ、感染症ワクチンとしての開発が進められていました。通常、ワクチン開発は供給まで15年以上はかかるといわれていますが、新型コロナウイルス感染症のmRNAワクチンがわずか1年ほどで実用化に至ったのは、こうした基盤があったことが理由の一つになっています。
ウイルスそのものを体内に投与しない
mRNAワクチンの重要な点は、従来のワクチンと異なり、ウイルスそのものを体内に投与しないというところです。コロナウイルスの場合、今回の新型に限らず、ウイルスの細胞表面に突き出しているスパイクタンパク質がヒトの細胞表面に結合することによって、ウイルスが侵入し感染を引き起こすことが分かっています。mRNAワクチンでは、新型コロナウイルスの遺伝子情報をもとに、新型コロナウイルスのスパイクタンパク質を産生するように設計されたmRNAを体内に投与します。
体内でスパイクタンパク質がつくられると、免疫システムが異物だと認識して、新型コロナウイルスの抗体が産生され、ウイルスが体内に入ってきても、抗体がウイルスを中和します。この抗体を介した免疫を液性免疫といいます。それに加え、免疫細胞がウイルスに感染した細胞を攻撃する細胞性免疫も活性化されます。これら2つの免疫により、感染や重症化の予防効果が発揮されるというわけです。
また、スパイクタンパク質だけでは感染することはなく、しかもmRNAはタンパク質をつくり出した後、速やかに分解され消失するという特性を持つため、ヒトの遺伝子に影響を及ぼしません。つまり、ウイルスそのものを使わないうえに、ヒトの遺伝子を傷つけないため、従来のワクチンよりも安全性が高いと考えられています。
加えて、従来のワクチンでは病原体ごとに設計が必要である一方、mRNAワクチンの場合は、他の病原体でも遺伝子情報が解析できれば、同じような設計でワクチンを開発することが可能です。実際に今回も、前述したようにインフルエンザ、ジカ熱のワクチン開発の知見が生かされ、また、新型コロナウイルスの変異株に対しても、モデルナ社がすでに南アフリカの変異株のワクチンの臨床試験を行うと発表しています。しかも、いまや遺伝子の配列は簡単に解読できる時代で、新型コロナウイルスが初めて報告されたのが2019年末でしたが、翌年1月10日の時点には中国の研究者によってウイルスの遺伝子配列がすべて解読されていました。
mRNAワクチンの副反応と効果も徐々に明らかになっています。mRNAワクチンの副反応には、投与部位の痛みなどの局所反応や発熱、倦怠感、頭痛などの全身反応があり、他のワクチンでもみられる症状です。全身反応については、2回目に投与したときのほうが強く出る傾向にあります。例えば、ファイザー/ビオンテック社製ワクチンの臨床試験のデータ(1万889人、18~55歳)では、発熱の発症率は1回目の接種で4%だったのが2回目では16%と増加しています。これは、1回目の投与後にスパイクタンパク質が産生され、2回目の投与で免疫反応が起きたために、熱が出ている、つまりワクチンが効いている証拠だと考えられます。
最も重篤な副反応がアナフィラキシーで、場合によっては死に至ることがあります。ファイザー/ビオンテック社の報告では、100万人あたり4.7人、モデルナ社の報告では2.5人です。抗生物質のペニシリンでは発症する人が約5000人に1人といわれ、一般的な薬剤で起きるリスクよりも低いといえます。また、約9割が接種後30分以内に症状が出ることが分かっているため、投与後約30分間の観察と発症時の早急な処置が重要になります。アナフィラキシーの既往、アレルギーがある人が起こりやすいというのも注意すべき点です。
効果については、ファイザー/ビオンテック社製ワクチンの臨床試験において、ワクチンとプラセボ(偽薬)の投与群を比較したところ、2回目接種7日目以降で95%という有効率(発症予防効果)が報告されています。モデルナ社製も94%と同程度の有効率で、両製品とも高い有効率ですが、その効果がどのくらい持続するのかということについては時間が経過してみないと分かりません。ただ、モデルナ社製のワクチンで抗体の量の変化をみたデータでは、4カ月経っても若干減っている程度で、半年~1年ほど効果が続くと期待できます。
変異株にも安定して供給ができる体制
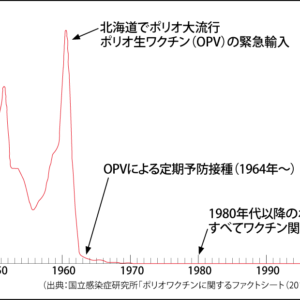
以上のように、高い安全性と効果が期待されるmRNAワクチンですが、供給不足が大きな課題です。特に、わが国では海外からの輸入に頼っているため、ワクチンの供給量が予定を下回り、接種計画に遅れが生じています。やはり国産で、かつ効果、安全性の高いワクチンを開発し、変異株に対しても安定したワクチン供給ができる体制を整えることが重要です。
そこで、私たちの研究グループ(ナノ医療イノベーションセンター〈iCONM〉・東京都医学総合研究所)は、2020年4⽉から新型コロナウイルスのmRNAワクチンの開発に取り組んでいます。開発でまず重要なのは、mRNAを安全かつ効率的に細胞に送り届けるための技術です。mRNAはそのまま体内に投与するとすぐに分解されてしまうため、細胞に届くまで保護する必要があり、実現するには高度な設計と技術力を要します。
私たちは、その保護の役割を果たすナノマシンと呼ばれる高分子ミセルをすでに他の疾患の研究で開発していました(図2)。ナノマシンは約50nmの小さなカプセルで、一般的な光学顕微鏡では見えず電子顕微鏡でしか確認できません。⽣体適合性が⾼いポリエチレングリコールとポリペプチドからなり、カニクイザルで毒性試験を行い安全性が確認されています。mRNAを内包したナノマシンは細胞内にエンドサイトーシス(細胞が細胞外の物質を取り込む過程)で取り込まれた後、崩壊してmRNAを放出します。
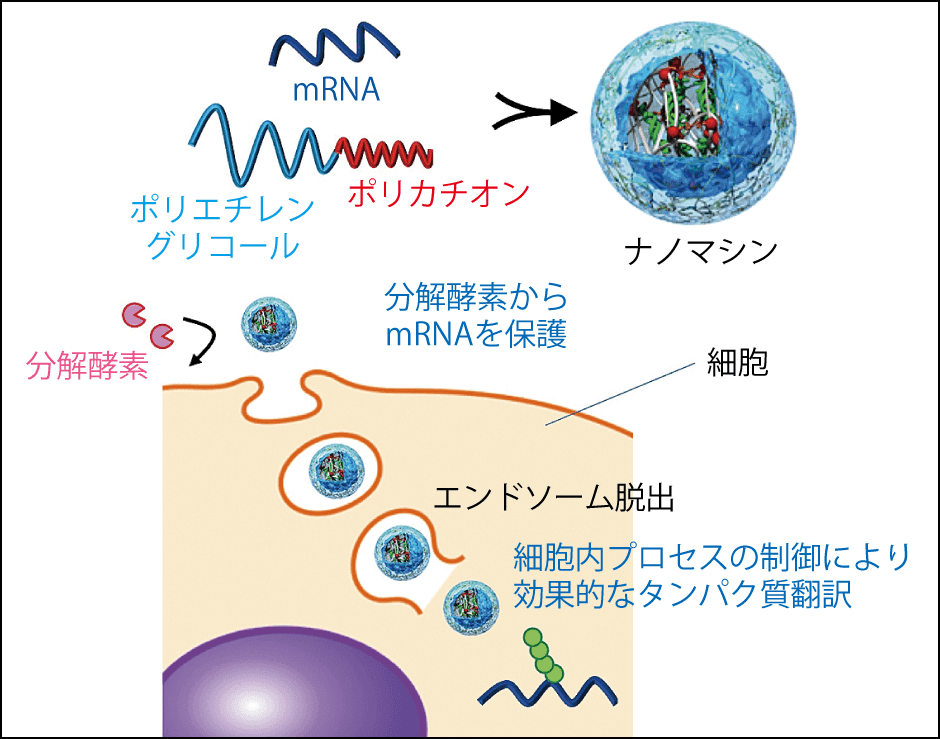
図2 ナノマシンの機能mRNAを保護するカプセルとして、先行するmRNAワクチンとは異なる独自の技術で開発したナノマシン。
こうして放出されたmRNAがスパイクタンパク質をつくり出すわけですが、それだけでは免疫が誘導されないため、免疫細胞を活性化させる必要があります。ファイザー/ビオンテック社、モデルナ社のワクチンの場合、脂質性ナノ粒子でmRNAを保護するとともに、その脂質成分が免疫細胞を活性化させています。しかし、脂質は小さな分子なので全身に分布し、肝臓で代謝されるため、不要な部位まで免疫が活性化され炎症反応を起こすことが懸念されます。それに比べてナノマシンは、このような全身への分布がなく、狙った細胞にだけ届きやすく、安全性を向上できるという仮説のもとに設計されています。
では、どうやって免疫細胞を活性化させるのか——。私たちは新型コロナウイルスの構造に注目しました。新型コロナウイルスは、遺伝子情報がつながった1本鎖のRNAですが、自らを宿主(ヒト)の細胞にコピーし増殖するときには、2本鎖の構造になります。すると体内では、2本鎖のRNAを異物だと認識して、免疫細胞が活性化するのです。もともとmRNAは主に1本鎖の構造で、そのままでは2本鎖にはなりません。
私たちは、すでに過去の研究で2本鎖のmRNAをつくり実験を重ねてきました。その研究の一つでは、抗原となるタンパク質を⽣み出すmRNAをつくり、1本鎖mRNA、すべて2本鎖にしたmRNA(全長2本鎖mRNA)、一部分だけ2本鎖にしたmRNA(部分2本鎖mRNA)と構造を変えて、それぞれマウスの培養免疫細胞に投与しました。結果、1本鎖mRNAでは抗原タンパク質の産生効率は高いものの免疫活性化作用は低く、全長2本鎖mRNAは免疫活性化作用が高い反面、抗原タンパク質の産生効率が低くmRNAとして機能しませんでした。部分2本鎖mRNAは、mRNAと免疫活性化の両方の機能を維持し、最も適した構造であることが分かりました(図3)。さらに、部分2本鎖mRNAをマウス鼠径リンパ節に投与したところ、実際にリンパ節で免疫細胞が活性化し、液性免疫と細胞性免疫の両方を誘導できることも確認しました。さらに、ヒトから抽出した免疫細胞も活性化でき、マウスレベルでは毒性がないことも確認しています。
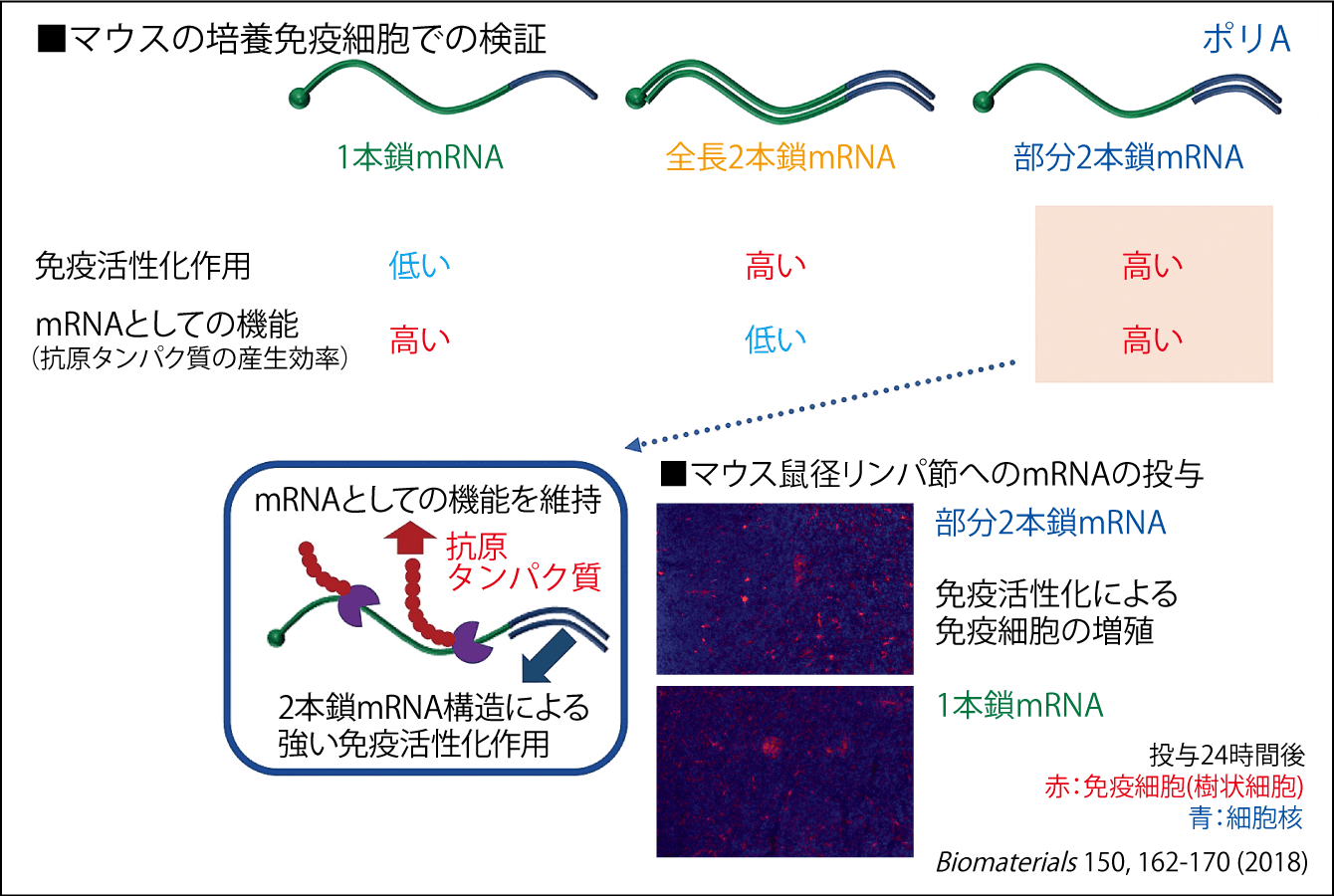
図3 効果的なmRNAの構造の検証mRNAの構造を部分的に2本鎖にすることにより、抗原となるタンパク質の産生と免疫活性化を実現した。
こうした研究をもとに構築した独自技術のナノマシンと部分2本鎖mRNAの相乗効果により、安全性、効果をより向上させたmRNAワクチン開発を目指しています。効果が高いほど、少ないmRNAの量で生産でき、安定した供給につながります。加えて、先行しているmRNAワクチンは氷点下での保存が必要ですが、ナノマシンには凍結乾燥の実績があり、これを応用すれば室温保存も可能です。
加速するmRNA医薬全般の研究開発
2021年中に動物実験を終えて、臨床実験に進むのが現在の目標です。もう接種が進んでいるかもしれませんが、日本では、欧米のようにスピード感のある開発が難しいのが現状です。しかし、ここでしっかりと技術の基盤をつくることで、変異株や新たな感染症、もしくは小児の感染症の多くを占めるRSウイルスなど、これまでワクチンの開発が難しかった感染症にも応用できます。それに冒頭で解説したように、mRNAによる治療は感染症だけにとどまりません。例えば、がんワクチン、がん免疫治療、ゲノム編集、抗体医薬、希少遺伝性疾患治療、タンパク質補充治療への研究が進んでいます。今回のmRNAワクチンの実用化により、mRNA医薬全般の研究開発が加速するでしょう
中でもがんワクチンは、がんで発現するタンパク質をつくるmRNAを投与し、免疫を誘導してがん細胞を攻撃するというもので、獲得した免疫により長期間効果が持続することが期待されています。現在、多くの企業がさまざまな固形がん、悪性黒色腫(皮膚がん)、白血病などをターゲットに臨床試験を行っています。私たちも、ナノマシンや部分2本鎖mRNAを用いたがんワクチンの研究に取り組んでいるところです。
これまでも、私たちはさまざまな疾患を対象に基礎研究を積み重ねてきました。マウスでの実験では、mRNAにより脳の中にゲノム編集ツール(CRISPR-Cas9)を導入して、脳の実質細胞(主要な機能を担う細胞)や神経細胞に対して効率的にゲノム編集を行うことに成功しています。これにより、遺伝性の脳疾患の治療への応用が考えられます。また、アルツハイマー型認知症は脳内のアミロイドβ(タンパク質の一種)の沈着が主な原因だとされていますが、アミロイドβに対する抗体をつくり出すmRNAをマウスの脳に投与すると、アミロイドβの量が減少することも実証しています。こうした研究の成果は、ターゲットとなる細胞を替えることで他の疾患にも応用ができます。これが大きなメリットで、mRNAの創薬技術は治療薬というよりも、体内でさまざまな治療薬をつくり出すシステムの開発だと私は捉えています。
残念ながら、日本ではmRNAを含め遺伝子治療の研究は欧米に後れを取っています。その背景には人材や資金不足などさまざまな問題がありますが、国産初のmRNAワクチン開発により、今後の遺伝子治療やmRNA医薬の発展につながることを期待しています。