脳と腸が双方向で影響し合う「脳腸相関」に関わる良い腸内環境をつくることは、そう簡単ではない。しかし腸内細菌叢をコントロールして適切な状態を保つ因子の存在が明らかになり、小腸にあるパネト細胞がその因子と関わっていることがわかってきた。このメカニズムの解明によって、心身の健康にこれまでとは違う新しいアプローチが可能になるという。
特集 脳と体と心 脳腸相関をコントロールする「因子」と「細胞」の存在
構成/飯塚りえ
小腸のくぼんだ部分を陰窩といい、基底部に大きな顆粒を持った細胞が並んでいます(図1)。これはパネト細胞と呼ばれ、小腸にしか存在しません。腸管に病原菌が侵入すると、抗菌ペプチドのαディフェンシンを含む顆粒を分泌して強力に殺菌する自然免疫の役割を果たしています。
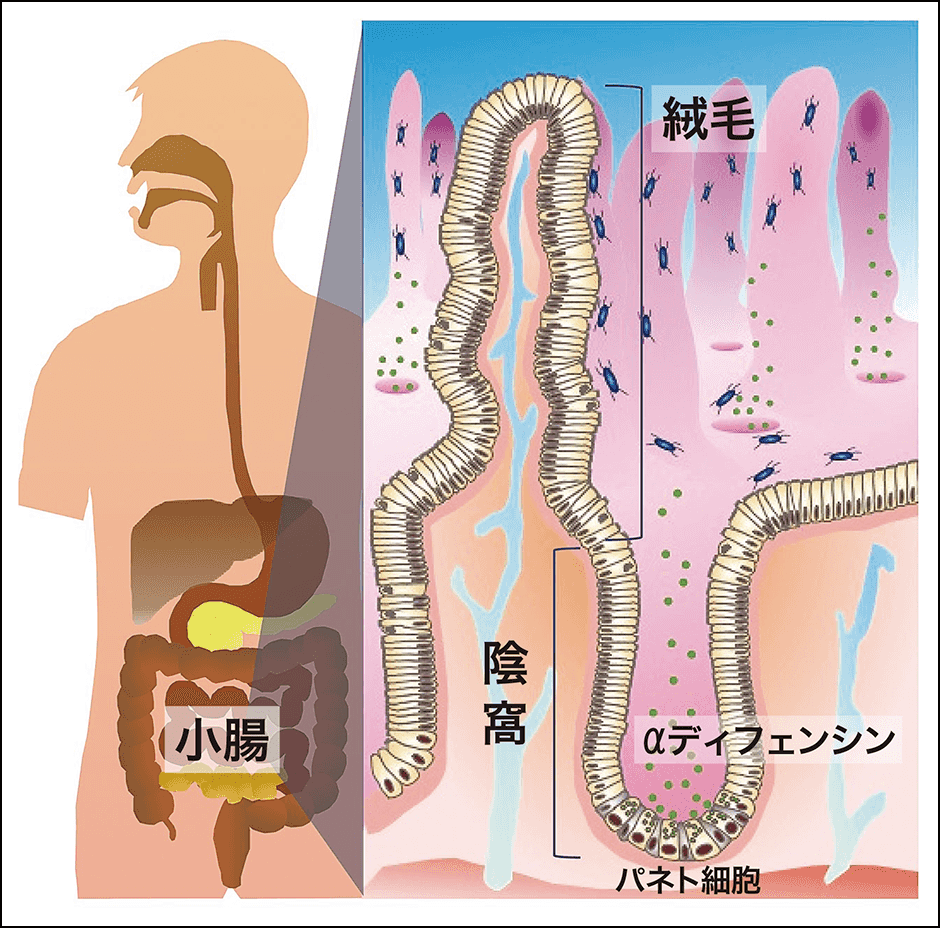
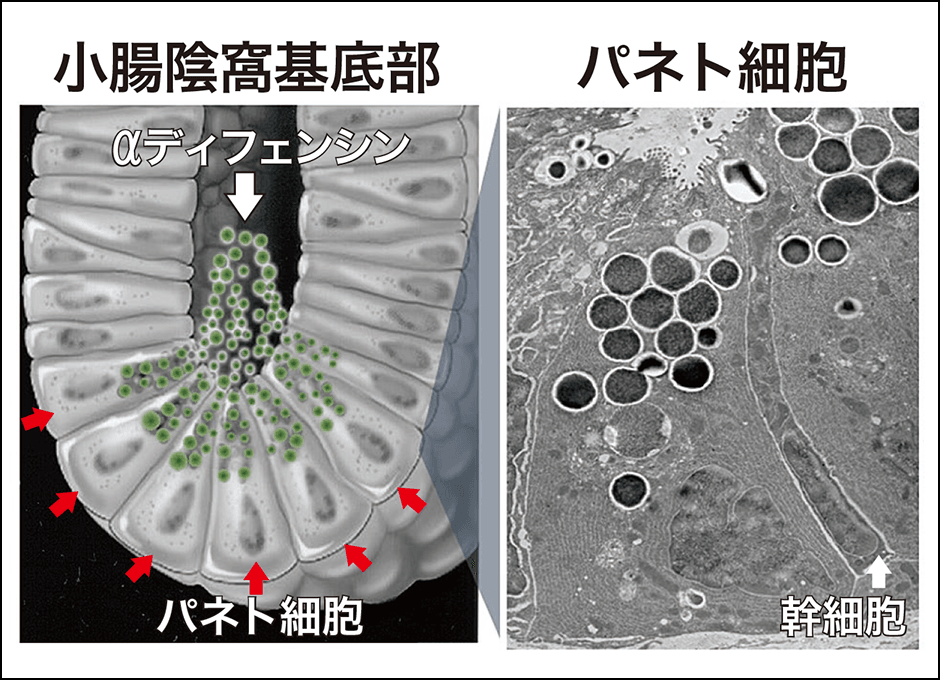
図1 パネト細胞パネト細胞は小腸に存在し、自然免疫の最前線を担う。
うつ状態のとき、腸内細菌が乱れることが知られてきていますが、具体的な機序はわかっていません。私たちは、ここに、αディフェンシンの作用が関与するのではないかと考えました。
腸内細菌叢をコントロールする因子
これまでの私たちの研究結果では、常在菌を含む代表的な腸内細菌に対するαディフェンシンの抗菌活性を見たところ、有害菌(病原菌)だけでなく、増えすぎると有害となる中間的な常在菌も排除されることが判明しました。一方で、ビフィズス菌や乳酸菌など健康維持に必要とされる有用な常在菌は死滅しません。ここからαディフェンシンが宿主に有益な腸内細菌の共生と排除を選択しているといえます(図2)。
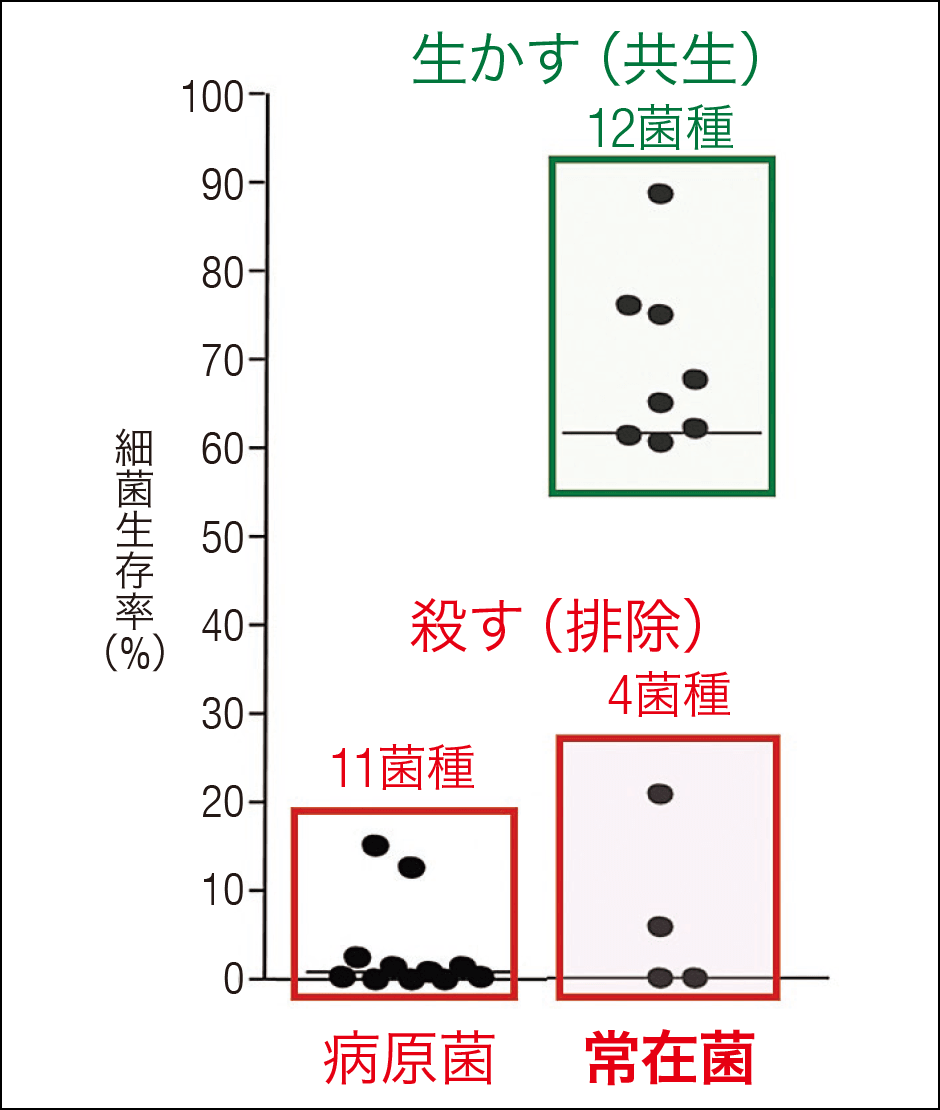
図2 αディフェンシンと腸内細菌叢αディフェンシンが正常に産生されている通常のマウス(野生型)では、宿主にとって有害な菌(エンテロコッカス属)や増加によって害を及ぼす中間的な菌(バクテロイデス属など)を排除する一方、有利な働きをする菌(ビフィズス菌、乳酸菌)は排除しない。
これらの結果から、αディフェンシンは腸内細菌叢の組成をコントロールして宿主にとって適切な状態を保つ因子であり、腸内細菌叢の乱れと相関があるクローン病やうつ病などの疾患にも関係しているのではないかと考えられました。
そこで、ストレスによってうつ様の症状を呈したマウスの小腸を調べてみると、顆粒を持ったパネト細胞の数もαディフェンシンの量も減っていました。腸内細菌叢もまた、健康なマウスとは組成が明らかに異なっていました。腸内細菌は、代表的なもので酢酸、酪酸などの短鎖脂肪酸、また脳内の伝達物質とされ、精神の安定に関わるセロトニンの前駆体を代謝物として産生します。これらの代謝物が不足していたり逆に増えすぎたりすると、血液や神経を介して脳に影響を与えると考えられています。今回、うつ病モデルマウスの代謝物では、脳の働きに関与することが知られているグルタミン酸やウラシルなどが減少していました。次にこのマウスにαディフェンシンを経口投与したところ、腸内細菌叢の組成が健康なマウスに近づき、グルタミン酸とウラシルなどの低下していた代謝物が正常値に戻ったのです(図3)。

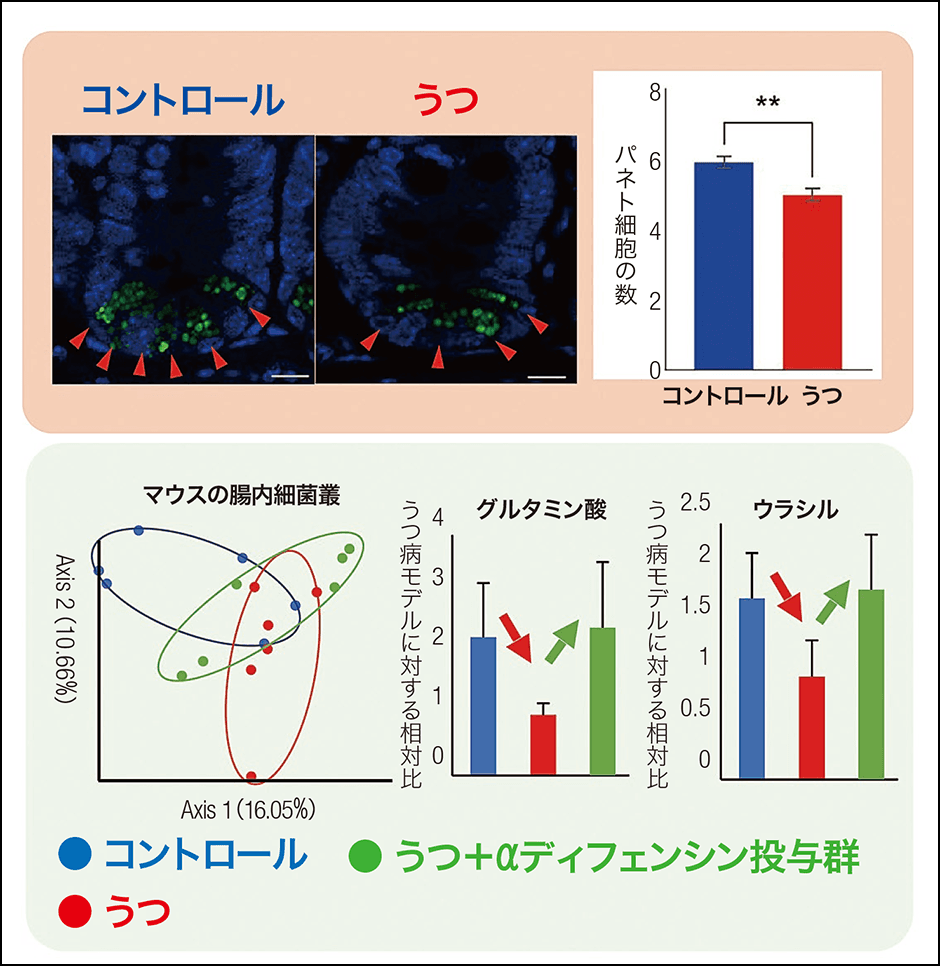
図3 うつ状態とαディフェンシンの低下、腸内細菌叢の変化の関連“うつ”状態ではパネト細胞の数が減り、かつ腸内細菌の代謝物であるグルタミン酸やウラシルが減少していた。αディフェンシンを経口投与することでその量が戻る。左下の図は、マウス各個体の腸内細菌叢の特徴を示している(点1つが1匹)。点と点の距離が近いほど似た細菌叢の特徴を表し、遠いほど異なった腸内細菌叢を表す。腸内細菌叢の多様性が見て取れる。
マウスのうつ症状が改善する結果についての検討は、これから着手するステップになりますが、ストレスがパネト細胞を減少させ、αディフェンシン量が低下して腸内細菌が乱れること、さらにαディフェンシンを経口投与することで腸内細菌叢が回復するという結果が得られたのは大きな成果でした。αディフェンシンを上手に用いてうつ状態に対して積極的なアプローチが考えられるということです。
加齢でも腸内細菌叢の組成は変化します。加齢に伴って、肥満や糖尿病、脂肪肝、また認知性やうつなどの疾患リスクが高まりますが、それは腸内細菌叢が変わるせいではないかとの報告があり、私たちはその背景にαディフェンシンの減少があるのではないかと考えました。
パネト細胞にも重要な役割
北海道・寿都町の地域コホート研究では、35歳から81歳の住民のαディフェンシン量を測定しました。すると加齢に伴って便中のαディフェンシン量が低下していくことがわかりました。加齢による疾患リスクとαディフェンシンの減少による腸内環境の悪化に関連があることを示唆した結果といえます。
αディフェンシン量の低下は、腸の免疫機能が低下していくことに結びついているのですが、逆にいえばαディフェンシンの量を適切に保つことで、加齢によるさまざまな免疫機能の低下(免疫老化)を抑え、疾患リスクを抑制できるのでは、と考えています。
現在は、食生活で適切にコントロールする方法について模索しているところです。
αディフェンシンを分泌するパネト細胞は、それ自体も健康と密接に関係しています。若年層に多く、腸に慢性炎症が起こるクローン病のモデルマウスの小腸を見ると、健康なマウスと比べて絨毛と陰窩の部分がかなり膨れています。健康なマウスのパネト細胞は内部に顆粒が見え、タンパク質を合成する小胞体は規則的に並んでいますが、クローン病モデルのほうはパネト細胞内の顆粒が収縮し、小胞体は波打って形が崩れているのが観察できます。小胞体がこのような形状だとタンパク質の合成がうまくできずに、異常な構造を持つひも状のαディフェンシン(還元型αディフェンシン)が大量に産生されます。この還元型αディフェンシンは常在菌に対して選択を行わずに、宿主に有益な菌もすべて排除してしまうため、腸内細菌叢の多様性が低下します。還元型αディフェンシンが増えていくに従ってクローン病スコア(病態の度合い)も上昇することから、宿主の健康を維持するためにはαディフェンシンの量だけではなく質も重要なのです。パネト細胞が正常に機能し、適切なαディフェンシンが分泌される必要があることがわかります。
厳密には、パネト細胞は幹細胞と隣り合って位置しています。腸管の細胞は3日ほどの周期で新しい細胞に生まれ変わっていますが、その新陳代謝を担う幹細胞に対して、隣にいるパネト細胞が新陳代謝を調節するシグナルを送っているとの研究結果もあります。これほどの短期間で細胞が生まれ変わる器官は腸の他にありません。腸は食物から栄養を得る器官ですから、細胞が若いほど効率よく栄養を吸収できます。一方で食べ物と一緒に菌が入ってきたときには死に至ることもあるので、即、攻撃しなくてはなりません。そういう器官に抗菌物質を出すパネト細胞が存在することは非常に合理的な仕組みです。ヒトが「食事をして栄養を摂り健康に生きる」営みにおいて、パネト細胞は重要な役割を持つのです。
腸内環境を見極めるための指標
パネト細胞とαディフェンシンの機能が明らかになってきたことで、心身の健康に、これまでとは違う新しいアプローチが可能になると考えています。「腸内環境を整えることが心と体を健康にする」ことが広く知られるようになって、「どの菌が体にいいのか」といった研究が数多く行われることになりました。個々の菌に関して研究が重ねられているのは良いことですが、一人ひとりの腸内細菌を考えると、情報過多になって、かえって正解がわからなくなっているのが現状です。
乳酸菌やビフィズス菌など、明らかに良いとされている菌は別として、例えば、ある特定の菌が増えすぎるのは良くないという一方で、ヒトによってはその菌があることで腸内細菌のバランスが保てている場合もあります。地域や国によって食文化や生活環境は異なり、腸内細菌叢の構成パターンも異なることが明らかになっています。当然、一人ひとりの腸内細菌叢も異なります。腸に存在する無数の菌のネットワークが宿主にどう影響するのかという非常に複雑な話であって、「良い腸内環境」を一様に語るのは難しいのです。
私はむしろ、αディフェンシンが腸内環境を見極めるための指標になるのではないかと考えています。
これまでは、腸内細菌というと菌を主体としたプロバイオティクスの研究が中心でしたが、私たちのチームでは宿主を主体に考え、αディフェンシンを十分に分泌させることを目的とした腸内細菌研究に取り組んでいます。
腸の中にいる共生菌はヒトのパートナーであり、さらに共生菌も一体とみなして一つの個体であるという解釈もあっていいと考えています。地球上にはさまざまな菌が存在しており、共生菌はその中でヒトの体を選んでいます。ヒトの体もすべてを受け入れるわけではなく、恐らく7割ぐらいの菌は排除してきて、折り合いがつきwin-winの関係を保てる菌との共生を長い時間をかけて確立してきました。
その共生菌を制御できるのは、やはり宿主であるヒトではないかと思います。私たちは食べ物を選び、抗生物質で体内の菌を排除することもできるからです。
αディフェンシンが宿主にとって有益な選択をしながら常在菌の排除と共生に関与しているのであれば、パネト細胞とαディフェンシンがきちんと機能することで宿主に最適な腸内細菌叢ができあがるわけです。プロバイオティクスの科学的重要性は明確ですが、私は足りない菌を体の外から摂って増やそうという視点だけではなく、自分にとっての「健康な腸内環境」は自分の体が知っているから、自分で体の機能を整えようと考え、食事でそうしたことができないかと研究を進めているところです。
試験管の中の培地に小腸の陰窩と同様のエンテロイドと呼ばれる組織を作って、食成分や腸内細菌代謝物を加えたときのパネト細胞の顆粒分泌を観察すると、短鎖脂肪酸やアミノ酸に反応します。また、パネト細胞は食成分に対する受容体やトランスポーターを持っていることも確認しています。食成分によってパネト細胞を刺激し、αディフェンシンの分泌を促すことができれば、セルフケアとしてストレスに強い体をつくり、うつ病など心理的な要因で発症する病気を予防できるのではないかと期待しています。腸内細菌叢を整えるために、細菌叢に直接働きかけるのではなく、宿主側、つまりパネト細胞の機能に働きかけるという新しいアプローチだと考えています。
腸内細菌のセルフケアで健康増強
腸内細菌は生体恒常性に深く関与しており、パネト細胞も腸内細菌叢の影響を受けています。無菌状態で飼育したマウスはパネト細胞があまり成熟しないのです。パネト細胞が十分に機能を発揮するためには、多様な腸内細菌叢が必要ということになります。
通常飼育のマウスは離乳直後から成体になるまでのタイミングでパネト細胞が一気に増えます。離乳して腸内細菌叢に多様性が増し、その個体に適した菌の構成ができあがっていく時期と、パネト細胞が急激に増える時期が一致しているということは、一生における腸内細菌叢の構成が決まるという局面で、パネト細胞も重要な役割を果たしているといえるでしょう。
そうなると、離乳期前後はもちろん胎児期からの栄養が何かしらの影響を与えるかもしれません。妊娠中の母体の肥満や痩せすぎが子の将来的な疾患リスクと相関するとの報告もあることから、私は胎児期や乳児期におけるパネト細胞の成熟に注目しています。
また腸内にどれだけαディフェンシンがあるのか調べるとき、現在は便に排出されたαディフェンシンの量を測っています。測定方法はすでに確立しているので、健康診断などでαディフェンシンの値を検査できるようになれば、こちらも多くのヒトの健康維持に貢献できると考えています。将来的には、クロマトグラフィーを応用して自宅で手軽に計測できるようにしたいとも考えています。腸内細菌叢のコントロールがうまくできているかを自分で検査し、一人ひとりの状態に適した食事で改善できるようになれば、生活習慣病をはじめ、うつ病などストレスに起因する疾患や、加齢に伴う不調など、心身のさまざまな病気を自分でチェックし、予防することが可能です。そういったセルフケアのベースとなる環境を整えたいと考えています。