感染した組織が免疫細胞の遊走を誘導するケモカインを産生すると、血液中の免疫細胞が感染組織へ遊走して細菌を貪食して炎症は収束するが、遊走が続くと健康な臓器をも攻撃し、リウマチなど自己免疫疾患が発症する。自己免疫疾患ではケモカインによる免疫細胞の遊走への関与は判明していたが、詳細は謎だった。しかし、免疫細胞や走化性因子の動態を可視化し、リアルタイムに解析できる新たなイメージングシステムの構築により、その機序が明らかになってきた。
特集 進化する「視覚化」 新たなイメージングシステムで関節炎病態の可視化に成功!
構成/菊地武顕
私たちの体をつくっている細胞は、皆、動いています。私たちが健康に生活できるのは、細胞が適切なタイミングで適切な場所へ動くことができるからです。つまり、細胞遊走は生命活動を維持するうえでとても重要です。
免疫細胞はケモカインを目印に集合する
この細胞遊走は、生体防御に非常に大事な役割を果たします。例えば、皮膚で細菌感染などが生じると組織が傷害されて、炎症性メディエーターが放出されます。①この炎症性メディエーターによって、血液中を循環している免疫細胞が感染組織に遊走してきます。②組織に入ると免疫細胞は活性化し、細菌を食べたりして除去することができます。①の遊走について説明しますと、炎症部では主にケモカインという細胞遊走を誘導する走化性因子が産生されます(図1)。循環している免疫細胞は、感染している組織に発現しているケモカインを目印に到着します。高速道路を走っている車が、パーキングエリアの看板を目印に到着するようなイメージです。この細胞遊走制御機構では最初、免疫細胞は血液中をフワフワと浮いて循環していますが、やがて血管の壁を転がるようになります。血管中でケモカインなどの走化性因子に覆われた壁を転がっているうちにスピードが遅くなり、最後にピタッと止まるのです。その後、免疫細胞は円形からアメーバ状になって血管内をはいずり回り、感染した組織への入り口を探して、ようやく組織に侵入します。
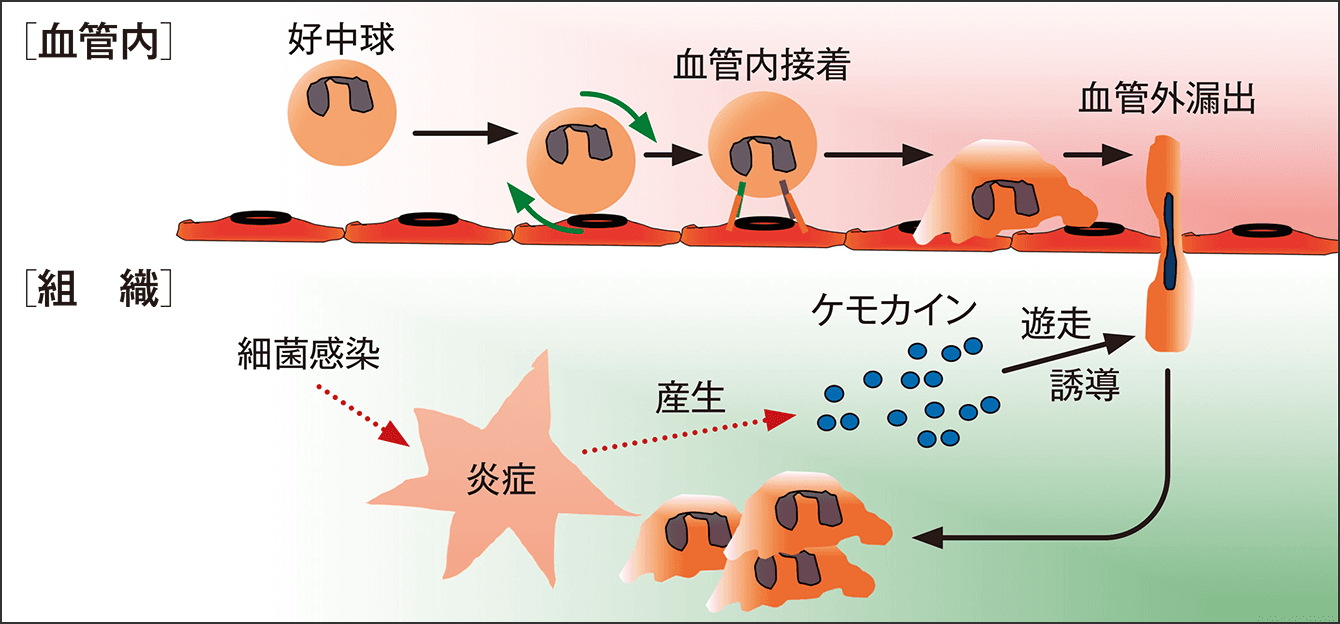
図1 細胞遊走制御機構血管内をフワフワ浮いていた免疫細胞は血管の壁を転がり始め、やがてケモカインを目印にピタリと止まり、血管外に漏出していく。
普通、炎症が収束すれば、免疫細胞は遊走しなくなります。しかし、ずっと免疫細胞が異常遊走し続けると、自己免疫疾患などの慢性炎症を引き起こすことがあります(図2)。
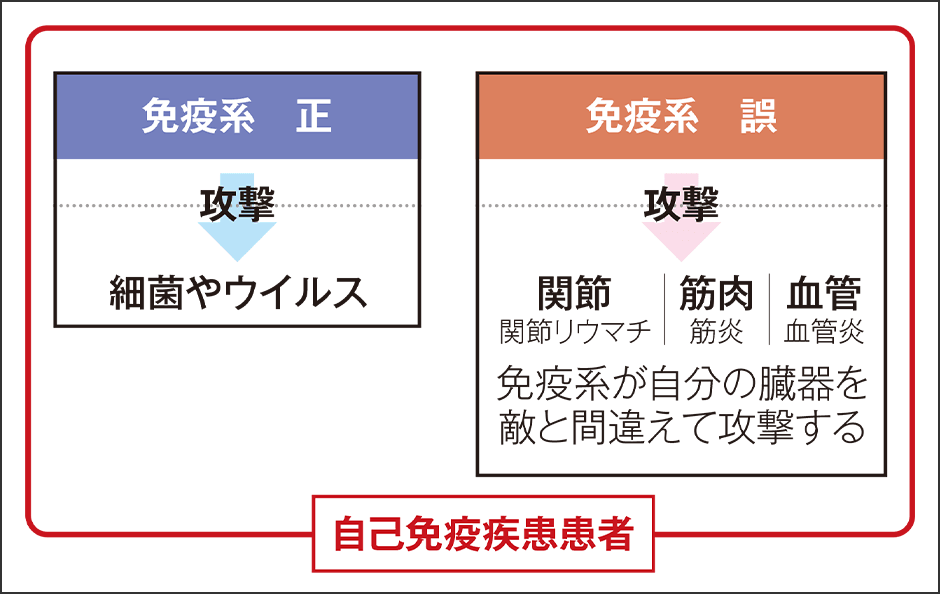
図2 自己免疫疾患のしくみ自己免疫疾患患者は、正常な免疫系と誤った免疫系の双方を持ち合わせており、自分の臓器を敵と間違えて攻撃を繰り返してしまう。
自己免疫疾患とは、免疫細胞が関節、筋肉や血管といった本来守るべき自分の臓器を、敵だと思い込んで攻撃し続けている状態です。関節への攻撃を繰り返せば関節リウマチ、筋肉を攻撃すれば筋炎、血管を攻撃したら血管炎を発症します。
従来の免疫抑制療法では、免疫系の活性化を抑える方法が取られていました。免疫細胞がいても、例えば関節の組織を攻撃しないのならいいという考えです。そのため自己免疫疾患の患者に、免疫抑制剤が投与されました。
遊走に関与する5つの受容体
近年、生物学的製剤の登場で関節リウマチに苦しむ多くの患者がその苦痛から救われてきました。しかし、効果のある人の割合は約30%程度で、薬剤抵抗や再燃の問題がまだあります。また、この治療によって患者の免疫系が抑えられてしまうことで抵抗力が弱くなり、感染症にかかるなどの合併症を起こすこともあります。
そこで、新規の免疫抑制療法として開発されているのが、免疫細胞の遊走阻害療法です。患部組織への免疫細胞の遊走を病変部位特異的に制御するのです。
免疫細胞が組織に入っていくメカニズムは、臓器ごとに異なっています。ですから臓器ごとに免疫細胞の遊走を制御するメカニズムが解明されれば、細胞遊走を臓器特異的に自在に制御することが可能になります。つまり、病変部位の免疫系だけを抑制し、他の健常な臓器の免疫系は維持することが可能になります。
私は、関節リウマチにおける免疫細胞の遊走メカニズムに関する研究をしています。これまでに、私たちは好中球に発現している脂質メディエーター受容体BLT1、ケモカイン受容体CCR1とCXCR2、補体受容体C5aR1と血管内皮細胞の補体受容体C5aR2が、好中球の関節への遊走に関与していることを発見しました。
一方で、好中球が関節へ遊走するのになぜこの5つの受容体が必要なのか、まったく分かりませんでした。データを基に推測して研究を進めてはいたものの、実際に正しいのかどうか、生体を見ることができずにもどかしい思いをしていました。生体を模した装置を作って実験をしたこともありますが、私たちの体内の環境とはまったく異なります。つまり、生体内で細胞遊走を解析する実験系が当時ありませんでした。
私が大学院4年生のとき、トーマス・T・ムロオカ博士(現カナダ・マニトバ大学准教授)が2012年に科学誌Natureに発表した論文を読んでインパクトを受けました。当時、博士はヒト化マウスを用いてHIVに関する研究をしていました。以前からHIVはT細胞に感染するということは分かっていましたが、具体的にどのように感染するのかは分かっていませんでした。博士の論文では、リンパ節でHIVに感染したT細胞がいびつな形態をとり、感染していないT細胞に接触し、HIVを感染させていく様子が映像として捉えられていました。生体イメージングシステムを使って、生体の中で何が起きているのか、細胞の動きや細胞と細胞がどういうふうにコミュニケーションしているのかなどをリアルタイムで見ることができたのです。私もいつか生体イメージングシステムを勉強したいと思うようになりました。しかし、当時それは、日本ではまだあまりなじみがない研究手法でした。
好中球が関節内に浸潤していく様子を観察
私は大学院を卒業後、アメリカ・ハーバード大学医学大学院マサチューセッツ総合病院に留学し、ケモカイン研究の先駆的研究者であるアンドリュー・D・ラスター博士の下で研究をしました。幸運にも同じ部門に、生体イメージングシステムの先駆者であるトーステン・R・メンペル博士がいました。ラスター博士はもともとメンペル博士と生体イメージングシステムに関する共同研究をしていました。実は先のムロオカ博士の研究成果は、ラスター博士とメンペル博士との共同研究によるものでした。ラスター博士の研究部門には、生体イメージングを行うのに最適な2光子励起顕微鏡や解析ソフトが備わっていました。
これは運命だと思い、私はラスター博士に関節内インビボイメージングシステムの構築の件を相談しましたが、博士の研究室では、今まで8人の博士研究員が関節内インビボイメージングシステムの構築に挑戦しましたが、成功した研究者はいなかったので、博士は当初乗り気ではありませんでした。しかし、私は諦めきれず、ラスター博士をなんとか説得し、メンペル博士と共同研究しながら関節内インビボイメージングシステムの構築に取り組みました。
当時、ムロオカ博士もメンペル博士の研究室で博士研究員をしていたので、ムロオカ博士に生体イメージングに関する基礎的な手技を学び、試行錯誤しながら関節内インビボイメージングシステムを作りました。試行錯誤した結果、私は関節炎マウスの下腿部位の毛をそり、丁寧に皮膚を剥離し、滑膜組織を露出させ、そこにレーザーを当てることによって、蛍光で標識した細胞や分子の動きを顕微鏡で観察することができました。これまでに関節内インビボイメージングシステムがなかなか成功しなかった理由として、適切な観察部位が分からなかったことや、外科的処置によって免疫細胞が組織へ遊走してしまったことが挙げられます。観察部位に関しては、私自身の膠原病・リウマチ内科医としての経験が役立ちました。外科的処置に関しては、マウスの手術を延々と続けているうちに、外的要因を除去するコツを習得できたのです。留学して半年後には、関節内インビボイメージングシステムが完成しました。ラボミーティングで、ラスター博士、メンペル博士、ラボメンバーが関節炎病態の映像を初めて見たときの反応は、今でもはっきりと覚えています。
こうして築き上げた関節内インビボイメージングシステムを用いて、私は関節リウマチが起きるメカニズムの解明に取りかかりました。
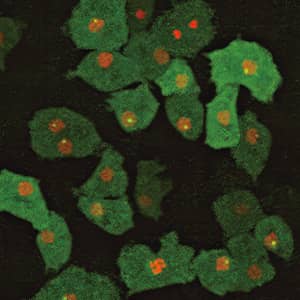
まずは免疫細胞の動きを見ました。先ほどお話ししたように関節炎において好中球に発現している4つの受容体が好中球遊走のキーになっています。では実際にこれらの4つの受容体がどのような作用をしているのか。そこを見ようと、野生型マウスならびにそれぞれの受容体の遺伝子を欠損させたマウスに、免疫複合体誘導性関節炎を誘導し、関節炎部位において受容体が好中球の遊走にどのように作用しているのかを比較観察しました。
野生型マウスでは、非常に多くの好中球が関節内に浸潤していく様子が観察できました。
一方で、それぞれの受容体の遺伝子を欠損させたマウスでは、まったく異なる動きが観察できました。4つの受容体には違う役割があることが分かったのです。C5aR1とBLT1は関節炎の発症に関わり、C5aR1は炎症の起点となる好中球の血管内接着に必須であり、BLT1は接着した好中球が関節組織に侵入するのに作用していることが分かりました。一方、CCR1とCXCR2は関節炎発症後に、CCR1は好中球の血管内接着、CXCR2は好中球の血管外漏出に関与していることが明らかになりました。
ところで関節リウマチはⅢ型アレルギー反応機序に分類されます。従来、III型アレルギー反応機序は組織に存在するマクロファージ、マスト細胞が炎症の起点とされています。しかし、関節腔は血流も遮断され、マクロファージ、マスト細胞といった免疫細胞が存在しない特殊な環境です。その関節腔に炎症が起きるメカニズムは、従来のⅢ型アレルギー反応機序では説明がつきませんでした。
そこで私たちの研究グループは、関節内インビボイメージングシステムを用いて、関節組織で産生された補体成分C5aが、血管内腔に輸送され沈着し、循環している好中球の補体受容体C5aR1を介して、炎症の起点となる免疫細胞の血管内接着を誘導させることを発見しました。病態を可視化することで、従来と異なる、補体成分C5aが起点となる新しいⅢ型アレルギー反応機序の発見につながりました。
リアルタイムに解析するイメージングシステム
2017年にScience Immunology誌に発表したこの研究成果は、アメリカ科学振興協会(AAAS)からその日のうちにハイライトとして“Tracking movement of immune cells identifies key first steps in inflammatory arthritis”というタイトルで報道されました。また約30の海外メディアからも注目を集めるなどの反響を呼びました。
従来の生体イメージングは細胞動態を見るのに対し、私たちは組織における走化性因子の動態をリアルタイムに解析する新しい生体イメージングシステムの構築に成功しました。これまで走化性因子の受容体には、シグナル伝達を行う“Classical”受容体とシグナル伝達を行わない
2017年の研究成果では、関節組織で産生されたC5aが血管内腔に輸送され、血管内皮細胞上に沈着する点までは解明していたのですが、その輸送機序は分かっていませんでした。そこで、どういう機序でC5aが組織から血管内腔へ輸送されるのかを、関節内インビボイメージングシステムと走化性因子動態のリアルタイム解析を駆使して調べてみました。
その結果、Atypical補体受容体のC5aR2を欠損させると、補体成分C5aの血管内輸送が阻害されることが分かったのです。つまりAtypical補体受容体C5aR2がC5aを輸送することによって、Classical補体受容体C5aR1を介した血管内接着を誘導しているのです。
従来と異なるⅢ型アレルギー反応機序、Atypical補体受容体によるケモカインおよび補体分子の輸送メカニズム、Atypical補体受容体とClassical補体受容体の相互作用が炎症を引き起こすことを、2019年Science Immunology誌に世界で初めて報告することができました。2017年と2019年の研究成果は同誌にハイインパクト研究として特集が組まれました。
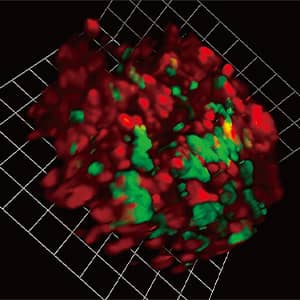
一方、病気は、関節だけにとどまりません。他の臓器についても、生体イメージングを適応し、可視化することができれば細胞の動きを解明することができます。現在、私は聖マリアンナ医科大学でスタッフとともに脳、心臓、皮膚、腎臓、肝臓、腸管などのさまざまな病気を可視化しています。一つの研究室で多臓器に対する生体イメージングシステムができるところは世界でもなかなかありません(図3)。
図3 宮部研究室でのイメージングシステム関節にとどまらず、マウスを用いて多くの臓器を見る生体イメージングシステムを構築。多臓器の細胞の動きを可視化した。
臓器ごとにメカニズムが違うのであれば、それぞれに特化した治療法があるはずで、それがどのようなものかを私たちは調べています。ただしこれは、あくまでマウスでの研究です。本来でしたらヒトの体内を見たいところですが、生きている人間に蛍光標識を用いてレーザーを当てて見るということは、技術的にも倫理的にもできません。
今後、そのあたりをどう克服するかは課題の一つです。私としては、なんとか細胞遊走のメカニズムを標的とした薬を1つは作りたいと思っていますが、一朝一夕には難しいでしょう。そこで当面の目標は、病気を可視化して得た研究成果を広く世に届け、世界中の研究者にそれをさらに発展してもらうことです。100年後、200年後に薬が開発されればと願っています。私の母も関節リウマチに罹患し、幼少期から痛みに苦しむ姿を見て、私は膠原病・リウマチ内科医を志しました。現在は基礎研究がメインとなっていますが、当時の気持ちを忘れず、これからも臨床に役立つ基礎研究を続けていきたいと思っています。