生物は互いに影響を及ぼし合いながら進化を遂げている。微生物も同様に、他の生物と関わり合いながら生命をつないできた。例えば、多様な細菌で構成されるいわゆる腸内細菌叢は、ヒトをはじめとするほとんどの動物と共生していて、宿主の生命活動に関与している。常在細菌叢もまた、宿主から大きな影響を受けている。そこで注目されるのが、ディスバイオシス(腸内細菌叢の異常)の原因となる因子だ。そのメカニズムが解明できれば、効果的な予防や治療につながる。
特集 腸内細菌最前線 健康や疾患に大きく関与する 腸内細菌叢を変容させる因子
構成/大内ゆみ
ヒトの常在菌の数は40兆個といわれており、30兆個とされるヒトの細胞数を超える数です。つまりヒトは、ヒトと常在菌のそれぞれの遺伝情報が融合した「超生命体」だといえます。ヒトを理解するためには、ヒト遺伝子の解析だけではなく、常在細菌叢を構成する細菌類とその遺伝子の総体(マイクロバイオーム)の解析が重要視され、多くの研究成果により、生理状態、ひいては健康や疾患と密接に関係することが明らかになっています。
ヒト腸内細菌叢は国によって大きく異なる
マイクロバイオームは、皮膚や口腔、小腸、大腸、胃など部位によって生息している細菌種や組成比が異なるとともに、個人差もあり実に多様です。また、ヒトの一生涯においてマイクロバイオームは不変ではなく、変動します。最近、子宮内の胎児は無菌であるという論文が複数の研究者の共著で発表されましたが、まず生まれた瞬間に、母親の産道、分娩室など環境に存在するさまざまな菌に暴露されます。ただし、そこら中にいる細菌がむやみに口腔や腸内に定着するのではなく、長い進化の過程で選択された菌が常在するようになると考えられています。
そして、母乳から離乳食といった食事の変化や生活環境の変化を経て、12歳ごろまでには腸内細菌叢がほぼ形成されます。その菌叢は、ある程度のばらつきはあるものの、成人期に安定的に維持され、その後加齢に伴い徐々に変化していきます。個人間の高い多様性の他に、女性のほうが男性よりも腸内細菌の種類が多い、つまり多様性が1.2倍ほど高いという性差もあります。この理由は不明ですが、世界的に女性のほうが長寿であることを考えると、寿命との関連が推測されます。
また、ヒト腸内細菌叢の菌種組成は国ごとでも大きく異なり、国間の多様性が高いことも私たちの研究で明らかになっています。この研究では、日本、中国、アメリカ、ペルー、ベネズエラ、フランス、オーストリア、デンマーク、スウェーデン、スペイン、ロシア、マラウイの12カ国の健常成人861人の腸内細菌叢をメタゲノムシーケンスにより比較しました。
- *1 メタゲノムシーケンス:微生物のゲノム情報を、培養を経ず直接的・網羅的に取得する解析方法。
日本人106人において、やはり個人間で高い多様性があるものの、菌種の相対的な存在比ではビフィドバクテリウム(ビフィズス菌)とブラウティア、バクテロイデスが上位3位を占め、12カ国の中で最もビフィドバクテリウムとブラウティアが多いという特徴が見られました。なぜビフィドバクテリウムが多いかというと、それは牛乳の摂取に関連していることが一因として考えられます。というのも、日本人の多くは、欧米人よりも牛乳に含まれるラクトースを分解する酵素であるラクターゼが少なく、分解されずに腸まで届いたラクトースがビフィドバクテリウムの餌になるからです。餌が豊富であるために、ビフィドバクテリウムが増えていると考えられるのです。
日本人に特徴的な腸内細菌叢
この研究では、さらに日本人および他の11カ国の腸内細菌叢に同定された遺伝子を基に、日本人が他国よりも統計学的に有意に多い、あるいは少ない機能を調べました。日本人の腸内細菌叢の特徴として分かったことは、炭水化物の代謝能が高い、鞭毛を持つ菌が少ない、修復関連の遺伝子が少ないことでした。炭水化物が代謝されると、短鎖脂肪酸、二酸化炭素、水素が生成され、このうち短鎖脂肪酸はヒトの栄養素となり、水素は抗酸化作用を発揮します。このため、炭水化物の代謝能の高さは、ヒトの生理状態に有利に働くといえます。また、鞭毛を有する菌が少ないと、ヒトは細菌の鞭毛抗原に対して免疫反応を起こすことから免疫による炎症反応が起こりにくくなります。修復関連の遺伝子が少ないことは、遺伝子の損傷が少ないことを意味していると考えられます。こうした特徴が、日本人はBMIが低く長寿であることと関係しているのかもしれません。
また日本人では、水素を代謝する菌として、ブラウティアが多い一方で、古細菌の一種のメタノブレウィバクテル・スミティーが少ないことも特徴的でした。水素の代謝において、メタノブレウィバクテル・スミティーはメタンを生成し、ブラウティアは酢酸を生成するため、日本人と他の国との間で腸内の水素代謝経路が異なることが示唆されました。実は、既存の研究で日本人の呼気に含まれるメタンの量が外国人よりも少ないことが分かっており、その理由がこの水素代謝経路の違いによるものだと考えられます。
他にも、約90%の日本人の腸内細菌叢ではノリやワカメの多糖類を分解する酵素ポルフィラナーゼの遺伝子が保有されるのに対して、他の11カ国では15%以下の保有率でした。通常、ポルフィラナーゼ遺伝子は海洋細菌にコードされています。日本人には、生魚や海産物を多く食べる食文化があるため、海洋細菌のポルフィラナーゼ遺伝子がヒト腸内細菌に水平伝播したと考えられます。
- *2 水平伝播:同一種間あるいは異種間で世代交代を経ずに遺伝子が伝わる現象。
各国の検出された菌種の存在比を見ると、前述したように国によって異なるものの、興味深いことに、日本を含めビフィドバクテリウムとブラウティアが多い群と、バクテロイデスが多い群、プレボテラが多い群の3つのグループに分類できることも分かりました(図1)。日本と同じグループは、スウェーデン、フランス、オーストリアで、一見すると共通点が見つかりません。バクテロイデスが多い群も同様ですが、プレボテラが多い群は、発展途上国という共通点がありました。
 Nishijima S, et al. DNA Res, 23: 125-133, 2016.を基に作成
Nishijima S, et al. DNA Res, 23: 125-133, 2016.を基に作成
図1 菌種組成からみた12カ国の関係国ごとの菌種組成の類似性を階層クラスター分析(対象となるデータ群を数学的に類似しているもの同士に分類)した結果、3つのグループに分類された。
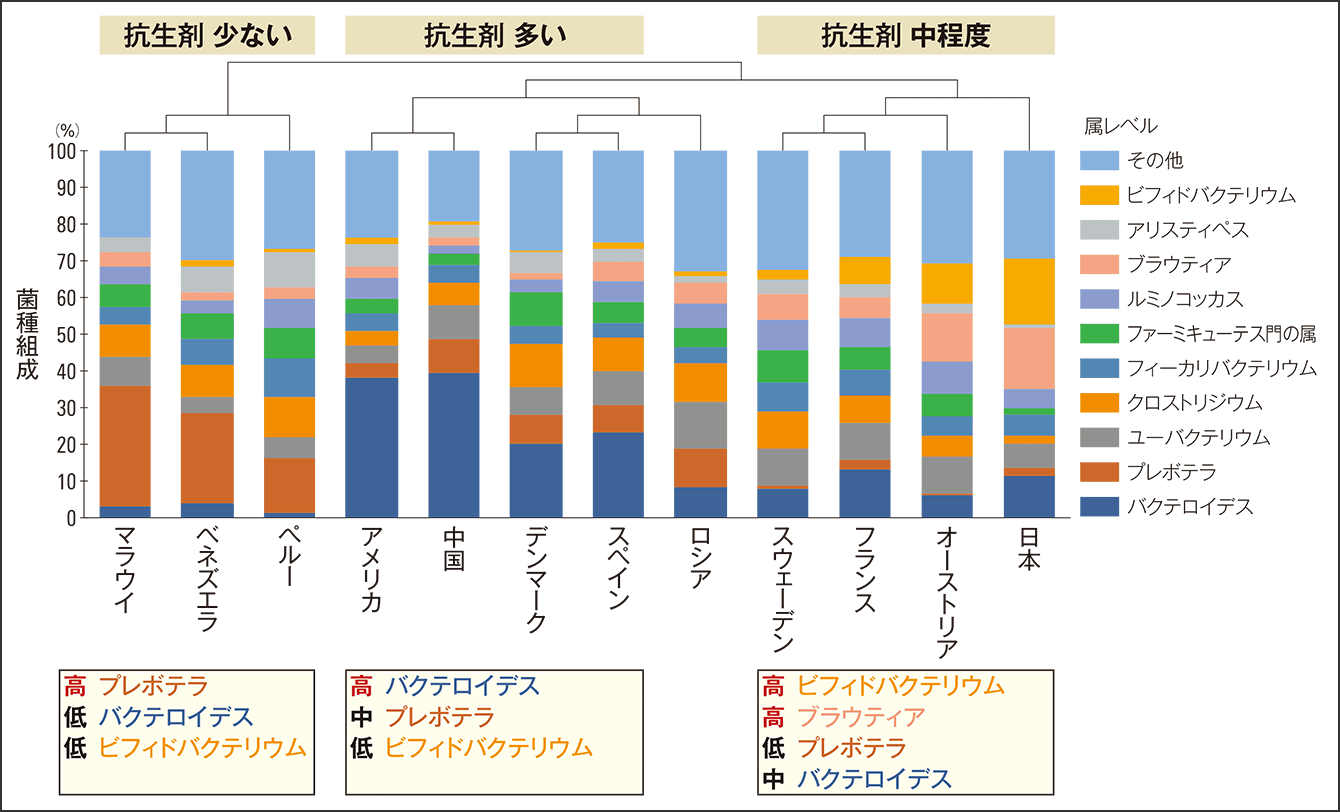
まず、腸内細菌に影響を与えると考えられるのは食習慣です。しかし、単純に考えても例えば日本とフランス、中国とアメリカでは食習慣が同じだとはいえません。実際に、世界的な食事情報のデータベースを用いて分析してみても、食事では各グループの類似性は説明できませんでした。つまり、食事以外に腸内細菌叢の形成に大きく影響する因子の存在が示唆されたのです。国の面積、緯度など無関係そうな因子も含めて調べていく中、見えてきたのが抗生剤の使用量でした。抗生剤使用のデータベースと同研究のデータを合わせて分析すると、抗生剤使用量が多い国がバクテロイデスの多い群、中程度の国がビフィドバクテリウムとブラウティアの多い群、少ない国がプレボテラの多い群だということが分かったのです(図2)。
 Nishijima S, et al. DNA Res, 23: 125-133, 2016.を基に作成
Nishijima S, et al. DNA Res, 23: 125-133, 2016.を基に作成
図2 抗生剤の使用量と菌種組成の類似性抗生剤の使用量は、腸内細菌叢の組成への影響が食事よりも大きい可能性が示された。なお、ロシアは同じグループ内で比較して、バクテロイデスの占める範囲が少なく、抗生剤の使用量は中程度だった。
加えて、抗生剤の使用量が多いほどバクテロイデスが多い、つまり正の相関を示し、特にペニシリンは高い相関を示すことも分かりました。この分析結果により、抗生剤の使用は食事よりも腸内細菌叢に大きな影響をもたらすと考えられました。抗生剤は感染症の特効薬ですが、病原菌以外の腸内細菌も殺してしまうことを考えると、その影響の大きさは容易に想像できます。抗生剤の使用量が多いとされるアメリカにおいては、肥満率と抗生剤使用量が正の相関を示す研究結果も報告されています。
食事よりも影響を与える薬剤
私が解明したいのは、ヒトマイクロバイオームに影響する因子が何なのか、そして、どの因子が大きな影響を与えるのかということです。内的因子として、年齢、性別、概日リズム、妊娠といったヒトの生理状態、遺伝的背景、疾患など、外的因子としては、生活環境、生活習慣、食事習慣、投薬などが考えられています。中でも疾患は、肥満や糖尿病、メタボリックシンドローム、腎不全、心不全などの代謝系疾患、炎症性腸疾患、過敏性腸症候群、関節リウマチ、動脈硬化症、アレルギー、肝硬変などの免疫・炎症系疾患、自閉症スペクトラム障害、多発性硬化症、認知症、パーキンソン病などの神経・精神疾患、そして大腸がん、肝がん、膵がんなどのがん疾患で、腸内細菌叢との関連が知られています。これらの疾患の患者の腸内細菌叢は健常者群と比較して、一般に腸内細菌叢を構成する菌種数が少なく(多様性が低い)、菌種組成も異なることが分かっています。このような健康なヒトとは異なった細菌叢の異常を、変容(ディスバイオシス)といいます。
こうした背景から、東京医科大学の永田尚義氏らと共同し、日本人約4200例を対象に、腸内細菌叢情報と被験者の食事や運動情報、疾患や投薬などの情報を統合したデータベースを構築しました。これは日本では初めて、世界的にも大規模なマイクロバイオーム・データベースです。メタゲノムシーケンスを用いて糞便DNAを解析し、腸内細菌1773種類(種レベル)、腸内細菌の遺伝子機能1万689種類、薬剤耐性遺伝子403個を同定しています。
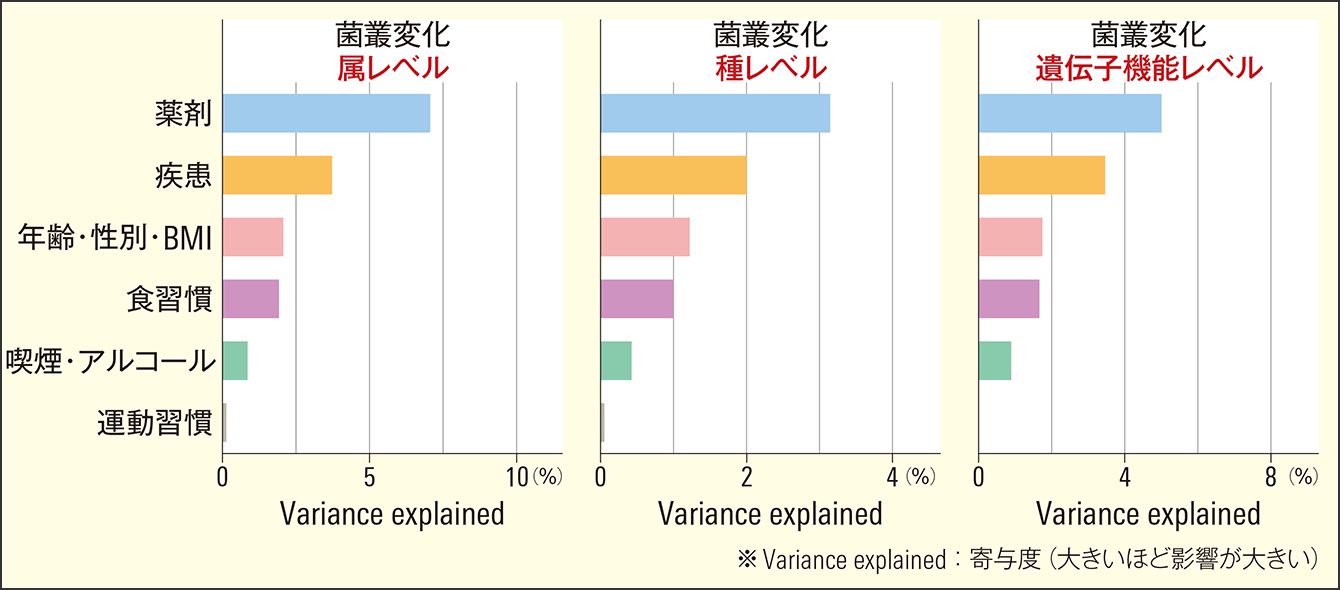
ここで分かったことは、薬剤の影響が最も大きく、次に疾患、年齢・性別・BMIなどの身体情報、食習慣、生活習慣(喫煙・アルコール)が続き、運動が最も低いという結果でした(図3)。しかも注目すべきは、薬剤が及ぼす影響が食習慣、生活習慣、運動より3倍以上も大きいということです。
 Nagata N, et al. Gastroenterology, 163:1038-1052, 2022 Oct.より改変
Nagata N, et al. Gastroenterology, 163:1038-1052, 2022 Oct.より改変
図3 腸内細菌叢に影響を与える因子薬剤が及ぼす影響は食習慣、生活習慣、運動より3倍以上も大きい。この影響の大きさは、腸内細菌叢を属、種、遺伝子機能等のさまざまなレベルで解析しても同様の結果を示した。
また、多くの薬を併用している人ほど、腸内細菌叢の多様性が低下し、日和見感染症を引き起こす病原菌の増加が見られました。日和見感染症は、正常の状態では病原性を発揮しない病原体が、宿主の免疫機能が低下したときに病原性を発揮して起こる感染症です。
腸内細菌叢への影響を考慮する必要性
どの疾患治療薬が腸内細菌叢に大きな影響を及ぼすのかを検証したところ、消化器疾患治療薬、糖尿病薬、抗生剤、抗血栓薬、循環器疾患薬、脳神経疾患薬、抗がん剤、筋骨格系疾患薬、泌尿器・生殖器疾患薬、その他(呼吸器系疾患薬や漢方薬)の順で影響が大きいことが分かりました。中でも特徴的だったのは、胃酸分泌抑制薬のプロトンポンプ阻害薬(PPI)と糖尿病治療薬のα-グルコシダーゼ阻害薬(α-GI)との併用で、単剤使用と比較して腸内細菌叢の多様性が低下したことです。α-GIは、消化管からの糖の吸収を遅らせることで血糖を下げる作用があり、PPIとともに代謝に関与する薬剤です。
さらに、同一患者でPPI投与前後の糞便を比較し、腸内細菌叢の変化は薬剤が原因なのか、または薬剤を摂取するような人はもともと腸内細菌叢が変化していたのかについても検証しました。PPIの使用開始後では、ラクトバチルスやストレプトコッカスが増加し、エンテロコッカス・フェシウムや肺炎レンサ球菌など日和見感染症を引き起こす病原菌種も増加することが分かりました。一方でPPIの使用を中断すると、これらの菌種は減少することから、薬剤の服用をやめれば、腸内細菌叢が元に戻る可能性も示されました。
やはり薬は毎日食べる食物とは異なり、体に強く作用します。それが腸内細菌叢を変えるのは当然のことかもしれません。薬剤の処方や開発では、腸内細菌叢への影響を考慮する必要性があると考えています。
これまで述べてきたように、腸内細菌叢、特にそのディスバイオシスがヒトの疾患や健康に関係していることは明白です。そして、ディスバイオシスが疾患発症の原因であったり、結果だったりします。よって、そのメカニズムを解明することができれば、ヒト腸内細菌叢をコントロールし、効果的な疾患の治療や予防につながると考えています。
しかし、腸内マイクロバイオームはまだまだ未知の部分が多く、細菌だけではなく、細菌に感染するウイルス(ファージ)や細菌などに含まれるプラスミドという小さなDNA分子などが存在しています。最近では、こうした深い部分まで見られるメタゲノムの解析方法も開発されています。これまで見えなかったところにこそ、疾患発症のトリガー因子があるかもしれません。その発見に向けて、今後もマイクロバイオームの研究に取り組んでいきます。