アルツハイマー病の原因物質に作用し、症状の悪化を抑制する抗アミロイド薬の実用化が2023年に開始された。効果的な治療法のない認知症にようやく一筋の光が差し込んだと話題になったが、考慮すべきは、この薬剤の対象は軽度の早期アルツハイマー病に限定される点だ。そのため、早い段階で正確に診断するためのバイオマーカーの開発が急がれる。とりわけ、効率がよく、非侵襲的で安価な血液バイオマーカーは健康診断などで広く活用できると、期待が寄せられている。
特集 血液のしくみと働き 認知症早期診断を可能にするアルツハイマー病バイオマーカー
構成/渡辺由子
超高齢化が進む日本では、2012年に厚生労働省が発表した推計値で、2025年に認知症患者数が700万人を突破し、65歳以上の高齢者の5人に1人が認知症に罹患するとしています。認知症の原疾患には多様な疾患が含まれますが、アルツハイマー病はその60~70%を占めるとされており、高齢になるほどその有病率は著明に増加します(図1)。
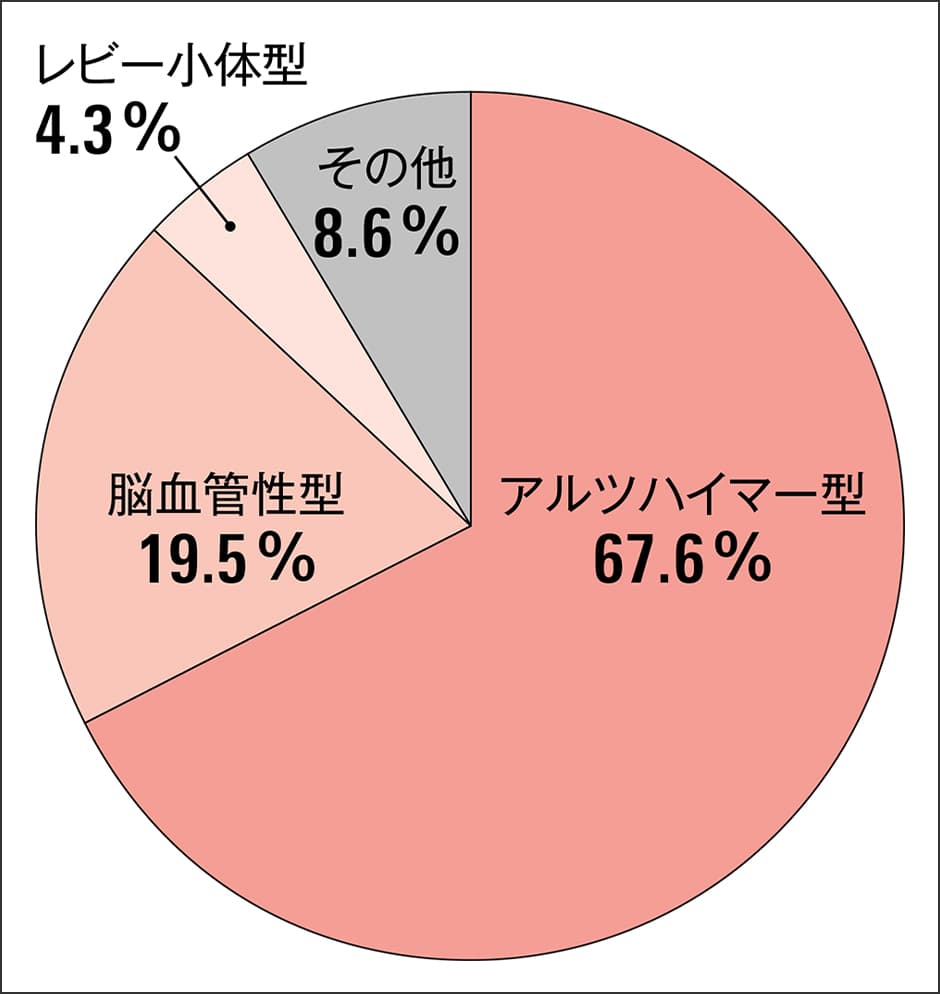 出典:都市部における認知症有病率と認知症の生活機能障害への対応(厚生労働科学研究費補助金疾病・障害対策研究分野認知症対策総合研究)
出典:都市部における認知症有病率と認知症の生活機能障害への対応(厚生労働科学研究費補助金疾病・障害対策研究分野認知症対策総合研究)
図1 主な認知症の種類と割合認知症の原因疾患で多いのがアルツハイマー病だが、脳血管性型やレビー小体型などと混在する症例があり、正確な診断を難しくしている。疾患修飾薬の使用に最適な時期を判定するのが難しい。
神経細胞が障害されて進む大脳の萎縮
アルツハイマー病は神経変性疾患の一つで、その特徴は脳実質の細胞外に蓄積するアミロイドβタンパク(Aβ)から成る老人斑アミロイド、神経細胞内に凝集・蓄積するタウタンパクから成る神経原線維変化、神経細胞が障害されて進む大脳の萎縮です。認知症を発症する20年ぐらい前から、Aβのアミロイド病理が脳内に凝集・蓄積し、それによってタウタンパクのリン酸化(p-タウ:phosphorylation tau protein)が誘導されて凝集・蓄積すると、神経細胞が広範に障害されて(神経変性:neurodegeneration)大脳が萎縮し、アルツハイマー病を発症すると考えられています。
健康な人でもAβは血中に存在し、p-タウも正常加齢で内側側頭葉にわずかながらも蓄積していきますが、なぜAβやp-タウが凝集・蓄積するのかは、解明されていません。ただ、アルツハイマー病の最も初期に出現するAβのアミロイド病理だけでは強い神経細胞障害は起こらずに、Aβのアミロイド病理によってp-タウが誘導され蓄積すると、神経変性とそれによる認知症が進むと考えられています。
2023年、アルツハイマー病において対症療法ではなく、疾患の原因となる物質に作用して発症や進行を抑制する日本発の疾患修飾薬(DMT:disease modifying therapy)の「レカネマブ」の実用化が始まり、認知症診療の転換点となりました。
DMTであるレカネマブは、Aβと選択的に結合して脳内から除去する作用があり、発症や進行を抑え、症状の悪化を防ぐ効果が期待できる抗アミロイド薬です。アルツハイマー病はAβが長い年月をかけて蓄積され、次第に認知機能が低下して発症しますが、レカネマブの投与対象は、発症前の軽度認知障害(MCI:mild cognitive impairment)からの軽度の認知症までの、いわゆる早期アルツハイマー病と限定されていることが特徴です。
ところが、アルツハイマー病の診断について、熟練した脳神経内科医でも診断が困難な症例が、特に早期アルツハイマー病の段階では、しばしば存在します。また、70歳以上になるとアルツハイマー病単独だけの症例はほとんどなく、脳血管性認知症やレビー小体型認知症などさまざまな神経変性の病理が、患者ごとに異なる頻度で混在する混合病理であることも、アルツハイマー病の臨床診断の正確性を難しくしています。
神経変性がどのくらい進んでいるかを診断
また、認知機能障害が現れている段階は、すでにAβが飽和状態にあり、タウ病理が進行していると考えられます。ところが、レカネマブにおける最適なターゲットは、本来はタウ病理が進んでいない「超早期」であるべきであり、投与のタイミングを把握する進行度を評価するのは、容易ではありません。
DMTの登場によって、アルツハイマー病の病態の解明、および的確な診断や治療の開発とともに、アルツハイマー病の患者を正確に診断するためのバイオマーカー(BM:biomarker)の確立が急務となっています。
BMとは、正常の生物学的過程、病的過程、あるいは治療的な介入に対する薬理学的反応の指標として、客観的に測定され評価される特性を有すると定義されています。例えば、正常の生物学的過程を表すBMには、食事を食べて満腹の状態を示す血糖値や、睡眠状態などを評価する脳波があります。病的過程や薬理学的反応についても、血中のPSA(prostate specific antigen :前立腺特異抗原)値は前立腺がんの腫瘍マーカーとして発症を捉えることができ、脳のMRI画像から脳梗塞急性期に血栓溶解薬の投与により、脳の組織を守れたかを判定することができます。
アルツハイマー病のBMに求められるのは、神経病理の本質的な特徴である、大脳に形成された老人斑(Aβが主成分)と神経原線維変化(p-タウから成る)を客観的に測定し、評価できることです。例えば、レカネマブのような抗アミロイド薬を使うには、Aβやp-タウの蓄積および神経変性がどのくらい進んでいるかを正しく診断できるBMであることが重要なのです。
2018年には、アルツハイマー病の脳病理のステージについて、BMによって診断・層別化するための枠組みである「ATN-BM」システムが提唱され、国際基準となっています。ATN-BMとは、アルツハイマー病の3つの特徴である、Aβの蓄積(A)・p-タウの蓄積(T)・神経変性(N)を反映するBMの結果を、+と-で評価し、組み合わせ、アルツハイマー病か他の神経変性疾患か、さらにはアルツハイマー病の進行度を表すステージを判定します。
このATN-BMに使用されているのが、画像BMとしての陽電子放射断層撮影法(PET:positron emission tomography)検査やMRI検査、体液BMの脳脊髄液検査(髄液BM)です。アミロイドPETやタウPETで、AとTのそれぞれの蓄積状況を鮮明に画像化することができ、病理診断の代替にもなりうる最も精密なBMです。髄液BMでは、A、T、Nを高い感度・特異度で検出できることから、有用性が確立、検証されています。Nについては、MRIによる病変の障害度も加えて評価します。
ただし、ATN-BMで用いられる画像BMと髄液BMには課題があり、PET検査は1日に実施可能な検査数が各施設3例ほどで効率性が低い、検査費用は15万~30万円程度と高額、PET検査が可能な施設が限定的などの問題があります。一方、アルツハイマー病のように頻度の高い疾患で、スクリーニング検査として位置づけられている髄液BMは、腰椎穿刺による患者への侵襲性の高さ、専門医が行うため簡便性や汎用性の低さに問題があり、画像BMを補完するほどではありません。
アルツハイマー病の早期診断や層別化診断を実現させるには、画像BMや髄液BMとともに、これら検査の短所を補完できる、効率性・低侵襲性・低コスト・簡便性・汎用性、かつ定量的な評価が可能な血液BMに注目が集まっているのです。
症状のない発症前期を評価する血液BM
2023年の国際アルツハイマー病学会では、近年進んでいる血液BMの研究開発を受けて、血液BMがアルツハイマー病の診断基準に取り入れられることになりました。ATN-BMにおいても、血液BMでの確立を目指して、国内外で開発競争が激化しています。
アルツハイマー病の診断・治療で求められているのが、臨床症状が存在しない発症前期や、治療開始に最適な超早期を評価する血液BMの確立です。私は神経内科専門医として、長年、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症、ダウン症候群などの、臨床症状だけでは正確な診断や重症度の評価が難しい神経変性疾患を、脳脊髄液や血液中に存在する疾患特異的な関連分子を定量することで、客観的かつ簡便に診断・評価を行えるBMの研究開発を進めてきました。これまでに、患者の髄液BMとして、パーキンソン病のαシヌクレイン、筋萎縮性側索硬化症のTDP-43などの異常タンパクを検出する、定量システムの開発に世界で初めて成功しています。
さらに、2017年9月に世界で初めて、これまで検出が困難、あるいは不可能だった血液中の微量のp-タウ181(タウ分子の181番目のアミノ酸であるスレオニンがリン酸化)を、従来の1000倍の検出感度を実現できる超高感度デジタルアッセイ技術であるSimoa(single molecular array)を用いて検出できる定量システムの開発に成功しました(図2)。
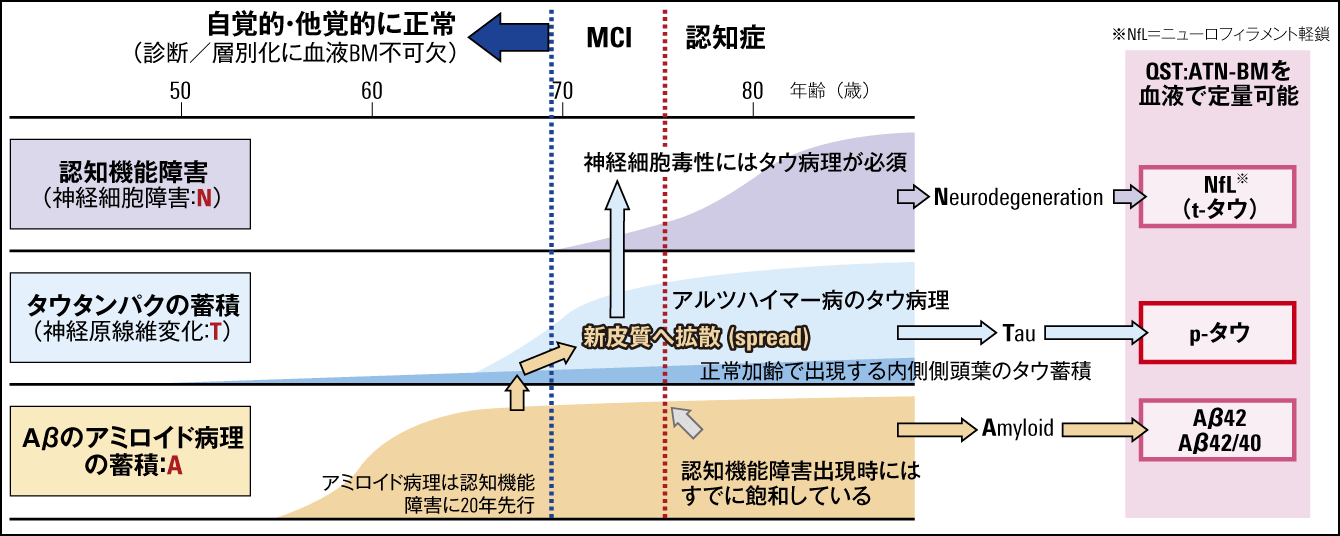
図2 アルツハイマー病の脳病態の時間経過とATN-BM認知症発症の20年くらい前からAβのアミロイド病理の蓄積が、それから5~10年遅れてタウタンパク蓄積が始まっている。認知機能障害は未発症だが、脳病理が始まっている超早期も含め、脳内で進行しているアルツハイマー病態を客観的に捉えるためにATN-BMが提唱されている。2018年の国際基準に提唱されたATN-BMは、画像BMと髄液BMだが、QSTでは、ATN-BMをすべて血液で定量することができる。
このシステムを用いて、実際の患者の血液中のp-タウを定量すると、正常対照群と比較して、アルツハイマー病患者群では血液中p-タウが統計学的に有意に高値でした。さらに、40歳代から大脳にp-タウから成る神経原線維変化が出現し始めることが分かっているダウン症候群の患者群でも比較した結果、このシステムで測定した血液中p-タウ値は、アルツハイマー病やダウン症候群患者の認知機能障害と最も密接に関連する神経原線維変化の出現を反映するBMであり、アルツハイマー病診断における血液BMとしての有用性を報告することができました。
2018年に国際基準に提唱されたATN-BMの体液BMとは髄液BMを指していますが、現在、私たちを含めた多くの研究グループにより、ATN-BMとして利用できるアルツハイマー病に特異的な関連分子をすべて血中で定量可能であり、国際的にもこれらのBMの有用性が続々と報告されるようになりました。疾患に特異的な関連分子種についても、ATNの各指標をより純粋に反映する分子種を新たに発見し、検証と議論を深めており、血液BMを巡る研究はいっそうの盛り上がりを見せています。
2020年に移籍した量子科学技術研究開発機構(QST:Quantum Science and Technology)は、変性疾患のPETプローブ(生体内のさまざまな分子の動きを可視化するために用いられる化合物)開発で世界をリードしています。
加えて、私たちの研究グループではATN-BMをすべて血液BMで検出することに成功するなど、血液BM開発に意欲的に取り組んでいます。他の疾患に特異的な物質の血液BMでの定量化の研究も進めており、いくつかで成功しています。筋萎縮性側索硬化症、あるいは前頭側頭葉変性症の原因タンパクであるTDP-43について、これまでは生化学的診断が不可能でしたが、私たちの研究グループが2021年に血液・髄液中での定量に、世界で唯一成功しています。
認知症性の疾患の脳病態を包括的に診断
開発した各種の血液BMと、それを用いた脳疾患診断による可能性を挙げると、1つ目は、認知症疾患・精神神経疾患の客観的で正確な診断と、層別化(重症度)の評価について、血液BMは高効率・非侵襲的・安価であり、第1段階の検査やスクリーニング検査で活用できると考えています(その次にPETで確定診断)。
2つ目は、多数の高齢者を対象にする自治体などの健康診査において、煩雑な神経心理学的検査や運動症状の評価を行う前に、迅速スクリーニング検査として用い、治療に活用することが可能だと考えています。例えば、55歳くらいに血液検査のATN-BMで確認した結果、「認知症は発症していないが、p-タウの値が高いので、Aβがたまっているかもしれない。まず抗アミロイド薬を投与して、Aβを減らしておきましょう」と早期の治療を開始。1年間ほど投与して、Aβがほぼゼロになれば、その後Aβが蓄積するまで3、4年はかかるので、しばらくは健康的な生活を送り、3、4年後に血液検査で確認する、というような治療法が考えられます。このように、患者一人ひとりの脳病理に合わせたテーラーメイド医療が、そう遠くない将来に実現できるのではないかと期待しています。
3つ目は、ATN-BMの血液BMが進化し、確実性と簡便性が高まれば、認知症のDMTの開発が加速度的に進むことが期待できます。
今後の課題として、1つ目はアルツハイマー病だけでなく、認知症性の疾患の脳病態を包括的に診断するために、現状のATNの枠組みを超えて、αシヌクレインやTDP-43、ミクログリアなど、さまざまな疾患関連物質をセットにした多項目BMが必要だと考えています。2つ目は、今後進められるDMTの治験で、対象となる患者の正確な抽出や治療効果の判定に、現状のATN-BMのような+か-の二値化した判定ではなく、定量的な評価のできるBMが必要です。3つ目は、血液BMの標準化の達成のために、大規模コホートによる検証を行いたいと考えています。
現在QSTでは、画像BMと体液BM(主に血液BM)を相互促進的に開発・検証して、最終的にはこれらを一体化した多項目BMシステムの確立と臨床応用を目指しています(図3)。
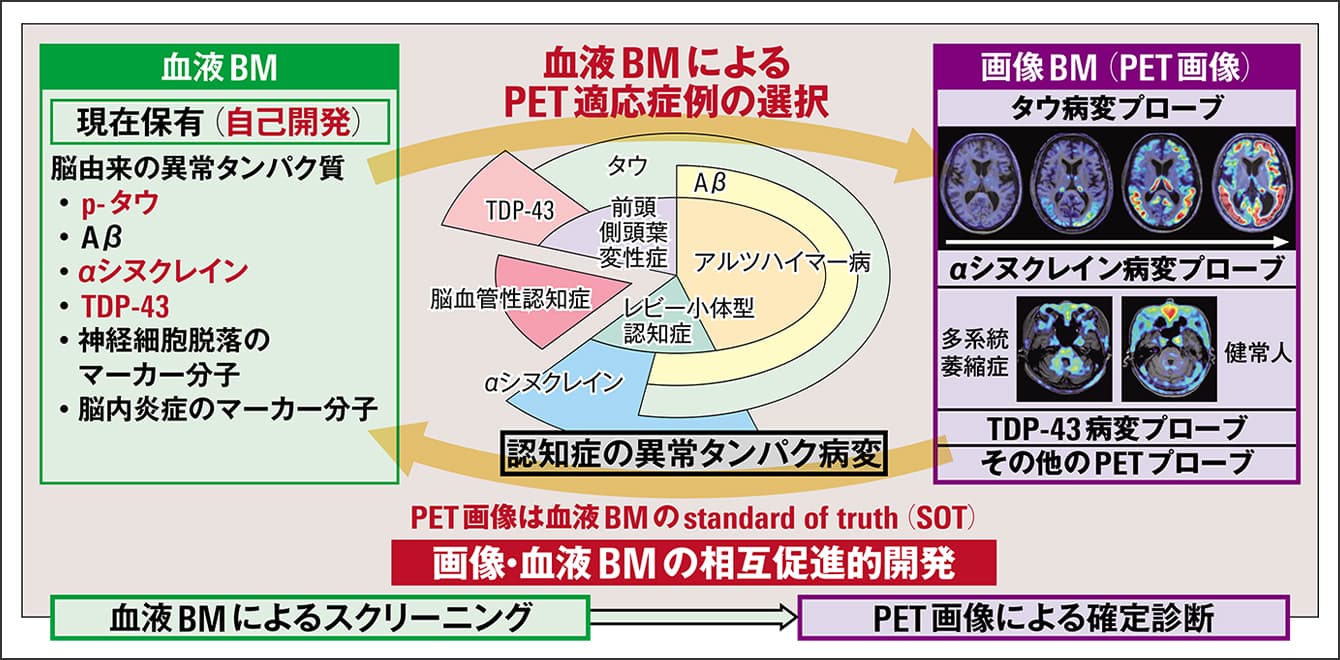
図3 QSTで展開中の画像・血液BMシステム開発QSTでは画像BM(PET画像)と血液BMの開発を相互促進的に行っており、自己開発した疾患に特異的な関連分子種を発見し、血中で定量が可能だ。将来的には多項目の画像および血液BMを統合し、一体化した認知症の包括的な診断・層別化システムの開発を目指している。
このシステムにより、認知症における日常診療から臨床研究までのすべての局面で、診断過程を革新的に進歩させることができると確信しています。