パーキンソン病は、神経伝達物質のドパミンを産生する神経細胞が変性したり脱落することで発症し、さまざまな症状を引き起こす。なかでも動くことが困難になり、手足が震え、筋肉がこわばり、姿勢を保てない——といった運動障害が特徴的で徐々に進行する。高齢者に多い代表的な疾患の一つで、有病率は増加傾向にある。薬物治療と運動療法の双方を早期から開始することが重要で、治療法が発展した今では、パーキンソン病が直接の死因になることはまずないという。
「神経難病」の最新治療 増加傾向のパーキンソン病 薬物治療と運動療法が重要
構成/渡辺由子
パーキンソン病(PD:Parkinsonʼs disease)は、動作の緩慢、手足の震えなどの運動症状が特徴的な、進行性の神経難病です。高齢者に多い代表的な疾患の一つで、国や地域、人種を問わず65歳以上で急増し、日本では人口の高齢化を背景に、70歳以上の有病率は100人に1人程度になっており、今後も増えていくと考えられています。日本をはじめ、世界中でも同じ状況であることから、「PDパンデミック」とも呼ばれています。
今では直接死因になることはまれ
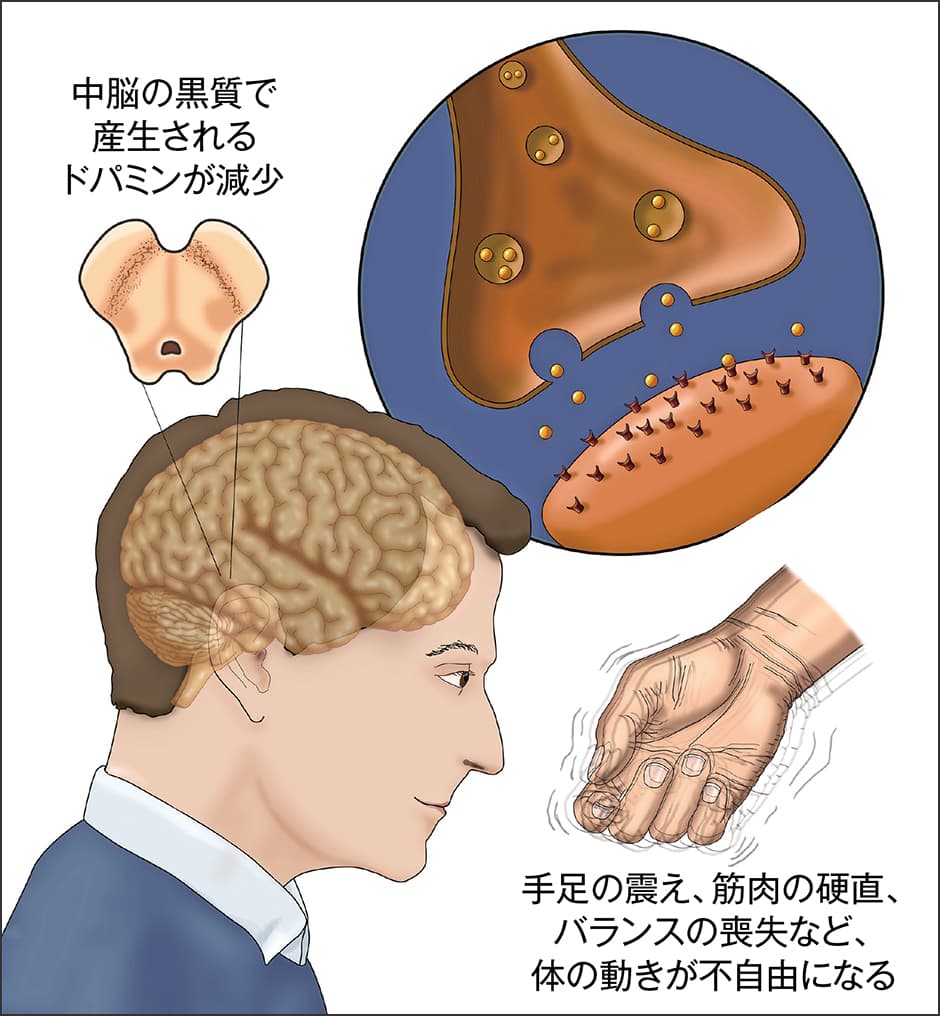
パーキンソン病は、大脳と脊髄の間に位置する中脳の黒質で、神経伝達物質のドパミンを産生する、ドパミン神経細胞が変性、脱落することにより発症し、さまざまな症状が現れます(図1)。中核症状は運動障害で、運動の開始が遅く、運動に時間がかかり、進行すると無動になる「運動緩慢(無動)」、静止しているときやリラックスしているときに手や足が震える「静止時振戦」、筋肉が硬くこわばり、動きが悪くなる「筋強剛」、体のバランスを崩しやすくなり、姿勢を保つことが困難になる「姿勢保持障害」を四大症状と呼んでいます。神経学的診察において、運動緩慢に加えて静止時振戦か筋強剛がある場合に、パーキンソン病と診断することができます。
 図版:Science Source/アフロ
図版:Science Source/アフロ
図1 パーキンソン病の病態体の運動に関わる神経伝達物質ドパミンは、中脳の黒質にあるドパミン神経細胞で産生される。何らかの原因でドパミン神経細胞が変性・脱落し、ドパミンの量が減少すると、手足の震えなど運動障害が起こる。
運動症状だけでなく、便秘や頻尿などの自律神経障害、抑うつや認知機能障害などの精神・認知・行動障害、睡眠障害、嗅覚障害などの感覚障害等々、全身に及ぶ非運動症状が現れます。
減少したドパミン神経細胞は再生されず、長い時間をかけて病状は徐々に進みます。しかし、パーキンソン病が直接死因になることはまれであり、さまざまな治療法が発達した現在では、健康な人と比べて寿命が大きく異なることはありません。
パーキンソン病の遺伝性の割合は10%未満で、40歳以下の若年層で発症した場合は、より遺伝の要素が強いと考えられています。遺伝性に関わる遺伝子が、現在30くらい見つかっており、その変異があると発症につながります。
一方、患者全体の90%以上は、家系にパーキンソン病の発症者はいない孤発性です。孤発性についても、DNA配列を構成する1つの塩基が置き換わった「スニップ(一塩基多型)」が、100種程度見つかっています。このうち1つでもあるとパーキンソン病を発症するわけではなく、発症リスクが数%程度高くなるといった、軽度のリスク上昇に影響すると考えられています。いくつかのスニップが組み合わさることで発症につながる可能性があり、多くの孤発性パーキンソン病が実は「多因子遺伝性疾患」だと考えられています。
さらに、環境因子についてもさまざまな研究が行われています。証明されていませんが、農薬の成分や、井戸水に含まれる微量の重金属などです。また、魚類を多く摂る人に発症が少ないことから、不飽和脂肪酸の防御作用などの研究報告があります。
腸内細菌叢の変異が関わるという説も
また、腸内細菌叢の変異がパーキンソン病に関わるという説が根強くあり、国内外で盛んに研究されています。ある研究では、遺伝子改変を行い脆弱にしたマウスに、健康な人の便を移植しても何も起こらないが、パーキンソン病患者の便を移植するとパーキンソン病のような運動障害が現れることを報告。疫学調査では、ある地域で便秘の人とそうでない人のパーキンソン病発症率を調べると、1日1回以上排便がある人は発症率が低いという結果を報告しています。
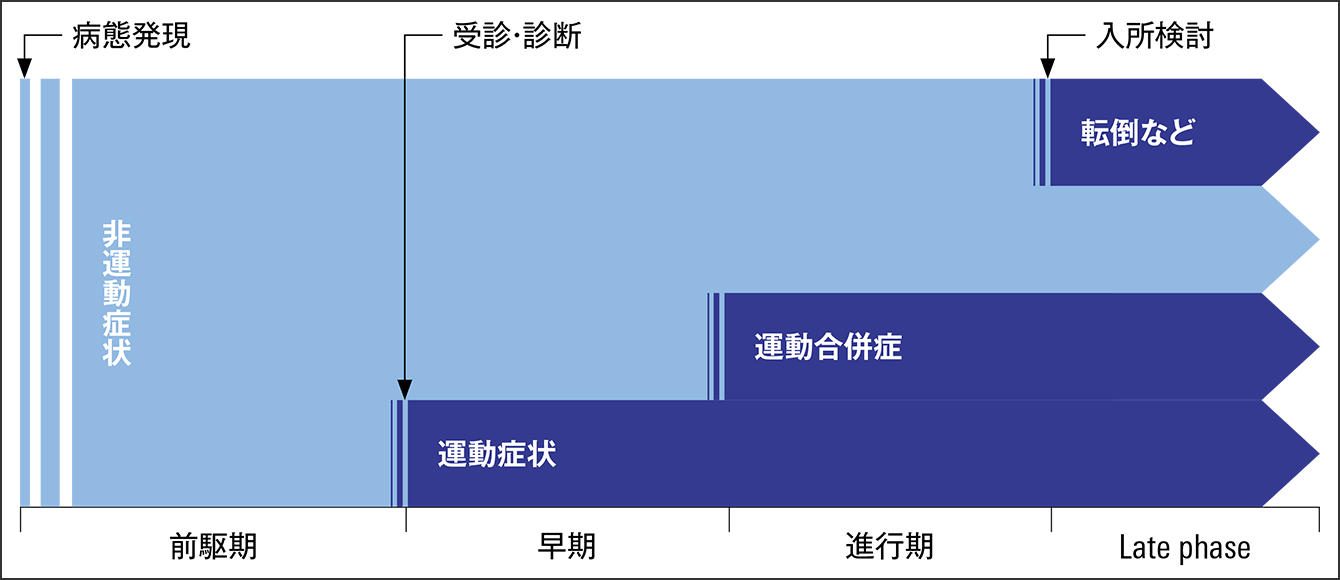
便秘はパーキンソン病の非運動症状の一つですが、運動症状の発症に先行する前駆症状として注目されています(図2)。つまり、発症の早い段階で腸管運動が低下し便秘が現れるとともに、腸内細菌叢が変化して発症につながる可能性もあります。
 武田篤編著. パーキンソン病療養指導士テキストブック. アルタ出版, 2023年, P27図2.
武田篤編著. パーキンソン病療養指導士テキストブック. アルタ出版, 2023年, P27図2.
図2 パーキンソン病の臨床病期とマイルストンパーキンソン病の主な症状は運動障害だが、病態は運動症状が出現する前から、便秘や嗅覚障害などの非運動症状が始まっていることが明らかになっている。非運動症状のみの病期を前駆期としている。
パーキンソン病の90%以上を占める孤発性パーキンソン病の病態を理解するうえで、スニップや環境因子に関するさまざまな研究に、今後も注目していきたいと考えています。
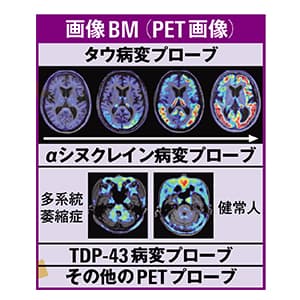
パーキンソン病は、1つの検査で確実に診断できるものではなく、さまざまな検査を行い、パーキンソン病に似た症状を呈する類縁疾患を除外する、鑑別診断が重要なポイントになります。問診や神経学的診察に加えて、脳の形態的な異常を調べる「脳MRI」、核医学検査のドパミン神経細胞終末部の構造物を画像化する「ドパミントランスポーター(DAT)シンチグラフィ」、パーキンソン病で特徴的な心臓の交感神経の機能低下を見る「メタヨードベンジルグアニジン(MIBG)心筋シンチグラフィ」の3つの検査を組み合わせて、パーキンソン病の類縁疾患を除外し、およそ90%の確率で早期から診断できるようになりました。
薬物治療と運動療法の早期開始が重要
パーキンソン病の治療は、薬物治療と運動療法が車の両輪に例えられるほど重要で、どちらも早期からの開始が良いとされています。薬物治療は、不足しているドパミン産生の原料となる「L-ドパ(レボドパ)」を投与し、ドパミンの補充を中心に考えていきます。神経回路網の維持に欠かせないドパミンが枯渇した状態を放置した期間が長いと、その後にレボドパを補充しても神経回路網の回復にはつながらないとされ、より早期の適切な診断と治療の開始が求められます。
運動療法についても、早期に始めることが勧められ、患者一人ひとりの症状や体力に合わせて、理学療法士や作業療法士、言語聴覚士などの専門家がリハビリメニューを組み立てます。通院する医療施設だけでなく、日常生活でも積極的に体を動かすよう勧めており、運動療法は、運動障害を軽減するだけでなく、便秘や睡眠障害などの非運動症状へも良い影響を与えています。
現在の薬物治療の中心は、ドパミン補充薬のレボドパで、その他のたくさんある薬剤は、不足したドパミンに伴う神経回路の乱れの是正や、レボドパやドパミンの分解を抑える薬剤などです。患者の年齢、性別、生活状況を確認し、総合的に判断して選択します。特に生活状況では、就労しているか、家庭での生活で子育て中かなど、生活上の運動量の必要度はどれくらいか、薬剤によっては眠気が生じる場合があるので車の運転の必要性があるかなど、患者一人ひとりの状況に合った、最も良い薬を勧めます。
レボドパは、他の薬剤よりも圧倒的に効果がある反面、長期間続けていると、次第に薬効の持続時間が短くなります。これを「ウェアリング・オフ」といい、初期には6、7時間続いていた薬効が、少しずつ短くなります。レボドパの薬効が2時間程度しか続かないために1日の服用が6、7回になることもあります。ウェアリング・オフを確認すると、その都度、投与量の調整や薬剤の変更等を行い、薬剤の長期間の効果持続を目指した適切な治療を進めていきます。
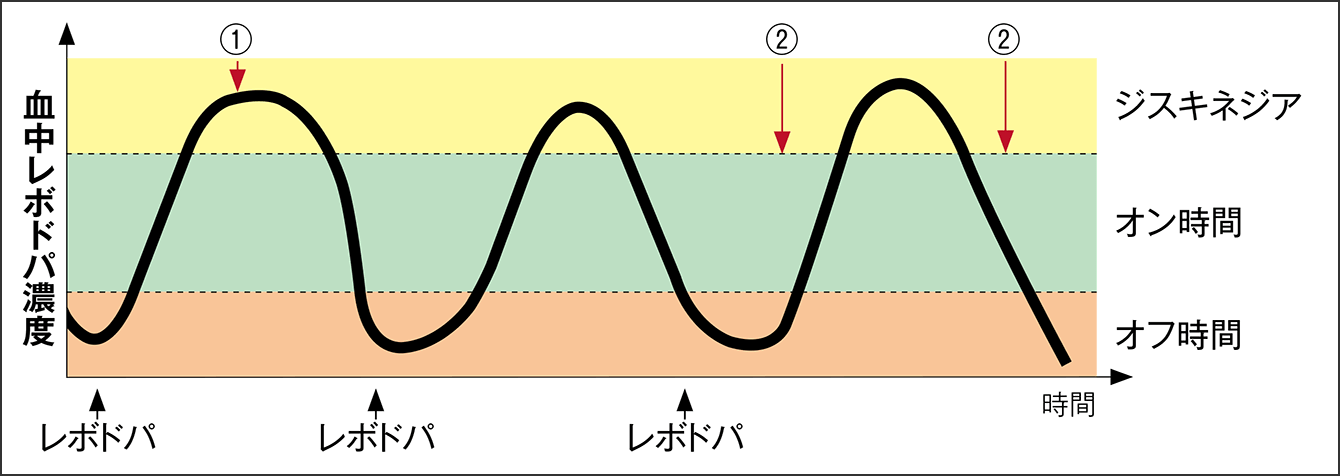
さらに、レボドパの投与量の増加に伴って生じる運動合併症、「ジスキネジア」があります。手足や首、胴体などがくねくねとよじれる不随意運動で、レボドパの血中濃度がピークになるときに現れる「ピークドーズ・ジスキネジア」、レボドパの効き始めと切れるときの2回現れる「ダイフェイジック・ジスキネジア」があります(図3)。
 武田篤編著. パーキンソン病療養指導士テキストブック. アルタ出版, 2023年, P25図3.
武田篤編著. パーキンソン病療養指導士テキストブック. アルタ出版, 2023年, P25図3.
図3 ウェアリング・オフとジスキネジア薬物治療のレボドパ服用では、薬が効いているオン時間、効いていないオフ時間があり、病気が進行すると、薬の効果が弱くなるウェアリング・オフが現れる。またレボドパの副作用に体が勝手にくねくねと動くジスキネジアがあり、レボドパの血中濃度がピークのときに現れる①「ピークドーズ・ジスキネジア」、レボドパの効き始めと切れるときの2回現れる②「ダイフェイジック・ジスキネジア」がある。
また、レボドパを急に断薬すると、40℃くらいの高熱や意識障害などが起こる「悪性症候群」に気をつけなければなりません。基本的に、パーキンソン病では薬効が切れると体の動きが悪くなり、不快感が生じるといった自覚症状が直ちに現れるので、自ら行う断薬は滅多にありません。しかし、「意図せぬ断薬」は身近にあります。例えば、夏に汗で水分が失われても、自律神経系障害の頻尿を心配して水分摂取を控えると、脱水状態になります。それに加えて、やはり自律神経系障害による便秘で1週間も排便がないような場合、きちんとレボドパを服用しても小腸からの吸収が低下し、血中濃度が下がってしまうのです。最近は毎夏、猛暑が繰り返されており、今年も高温の環境下での意図せぬ断薬に陥らないように十分に注意して、水分と塩分を適切に摂るようアドバイスしています。
ウェアリング・オフやジスキネジアが強く現れて、レボドパを増やせない状況になると、デバイス補助療法を選択します。1つが「脳深部刺激療法(DBS)」で、頭蓋骨に小さな穴を開けて直径約1㎜の刺激電極を脳の神経核に埋め込み、胸部か腹部に刺激発生装置を埋め込み、その間を接続して電気を流し続ける治療法です。しかし頭蓋骨に開けた穴から細い針を入れる過程で脳出血を起こす可能性や、そもそも手術に伴う体への侵襲もあるため、適応年齢は70代前半くらいまでとされています。
一方で人口の高齢化に伴い、70歳以上のパーキンソン病患者数が増えています。このため、以下に紹介するデバイスを用いたレボドパの持続投与法が選択される機会も増えてきました。その一つが、2016年に保険適用になった「レボドパ/カルビドパ配合経腸用液(LCIG)療法」です。胃ろうを造設し、チューブを空腸(小腸)まで30~40㎝入れ、体外の専用ポンプからレボドパとその効果を高めるカルビドパという薬剤を混合したゲル状の薬液を直接的・持続的に送り届けて吸収させる、画期的な治療法です。レボドパの服用では、服用のたびにレボドパの血中濃度が上がったり下がったりの波を繰り返しますが、LCIG療法は1日最大16時間まで、一定量を持続的に流すことが可能になりました。2023年4月の時点で、全国でおよそ1000人がLCIG療法を導入しています。
胃ろう造設のための内視鏡手術、毎日の胃ろう部分のケアやチューブの洗浄、専用ポンプやチューブの定期的な交換などが必要です。さらにチューブが腸内でとぐろを巻いたり、歩行時にチューブが擦れて胃ろう部分に糜爛ができるなど、チューブや皮膚のトラブルが起こることがあるので注意しなければなりません。
ドパミン神経細胞減少に関わるレビー小体
2023年7月、LCIG療法のような胃ろう造設を必要とせず、24時間持続投与可能、かつ簡便な「レボドパ持続皮下注射」が保険適用になりました。ホスレボドパ/ホスカルビドパ配合製剤という新しい薬液が入ったポンプから、腹部の皮下に留置したカニューレ(細くて柔らかい管)を介して、24時間持続的に一定量を投与できます。カニューレ留置は専用の器具を使って2~3日に1回、患者自身やケアギバー(専門的な訓練を受けた介護職員)が自己注射で行い、さらに同じ部位を使い続けないように位置をローテーションさせます。当院でも十数例で導入しており、患者の評価も良好です。
また、レボドパを経腸や皮下に注射の形態で投与するのではなく、手軽な服用薬として、ゆっくり時間をかけて薬効が続く徐放剤の開発も日本の製薬会社で進んでいます。2024年後半から治験の最終段階に入る予定で、順調に進めば数年以内に国内での発売になると期待されています。
さまざまな治療法が開発され、パーキンソン病治療の進化は著しいのですが、基本的には不足しているドパミンの補充療法です。ドパミン神経細胞の変性、脱落を食い止める、あるいは予防する、病気の本質に迫る根治療法ではありません。ドパミン神経細胞の減少の原因については、国内外の研究によって次第に明らかになってきています。その一つが、変性タンパクのαシヌクレインを主な成分とするレビー小体です。この塊がドパミン神経細胞に蓄積しダメージを与えることで、変性、脱落につながっていると考えられています。そこで、αシヌクレインの抗体を注射することで蓄積したレビー小体を溶かすことを目指す「抗体療法」が開発され、2020年ごろから世界中で治験が行われてきました。2024年4月、再解析の末に、パーキンソン病の進行の早いタイプでは、明らかな進行抑制効果が認められることが報告されており、今後も注視していきたいと考えています。また、ある種の糖尿病治療薬が、パーキンソン病の進行を抑える可能性を示唆する試験結果も報告されています。
レビー小体はレビー小体型認知症という疾患でも明らかなように、認知症発症の原因の一つです。パーキンソン病でも進行に伴って認知症を発症することが分かっています。認知障害が加わると、服薬遵守や運動療法の継続など、パーキンソン病治療の車の両輪がなくなるわけで、短期間ですべてが低下し、予後不良に陥ります。認知症の発症を食い止めることも、パーキンソン病治療においては非常に重要で、私たち研究グループは、パーキンソン病患者の認知症発症を予防する治療法の開発などを進めています。パーキンソン病の早期発見・早期治療、そして根治治療を目指して、あらゆる視点から診療と研究を続けていきたいと考えています。