1950年代に確立されたペプチド合成はその後も進化を遂げ、さまざま材料や製品開発、創薬など「ものづくり」に応用できるペプチドが数多く開発されるようになった。ペプチドで合成した金粒子を使ってがん細胞を特異的に熱して死滅させる光温熱療法や、再生医療に用いる細胞の培養界面の形成、ウイルスや爆発物を検知するセンサーなど、ペプチド合成が可能にする「ものづくり」はバラエティに富んでいる。
特集 ペプチドの世界 ペプチド合成が可能にする千差万別な「ものづくり」
構成/飯塚りえ イラストレーション/小湊好治
ペプチドは、アミノ酸から構成され、筋肉や内臓などヒトの身体をつくるのに欠かせない栄養素と考えることが多いと思います。しかし実はペプチドは栄養素としての側面だけでなく、人工的に合成することもでき、「ものをつくる」さまざまな場面で広く活用されています。
その一つが「バイオミネラリゼーション」を模した金属の合成です。バイオミネラリゼーションとは、生体が鉱物を結晶化させて形を作ることを指し、ヒトの歯や骨の他、微生物にも非常に精巧な形を作る種がいます。この機構にペプチドが関わっていることは以前から知られています。
近年、ペプチドでレアアースなど希少金属を結晶化できることが判明し、ペプチドを用いたバイオミネラリゼーションに関する知見が多く報告されています。
私たちも金のイオンを結晶させるペプチドを探索、人工的に作成すべく、研究を重ねました。
これまでに金微粒子の結合に関連しているとされるペプチドがいくつか知られているので、最初にそれらのアミノ酸組成を解析し、アミノ酸をさまざまに組み合わせてランダムに異なるペプチド配列を設計し、金に対するそれぞれの結合性能を比較しました。
その結果、トリプトファン(W)に挟まれているアミノ酸配列、ヒスチジン(H)とWに挟まれている配列、WとHに挟まれている配列がキーとなることがわかってきました(図1)。

図1 金微粒子を発生するペプチドの配列金微粒子の結合性が高い50のペプチドのうち46で、トリプトファン(W)をベースにした配列が見出された。Xは任意のアミノ酸。多くの場合、ヒスチジン(H)が含まれている。
がんの光温熱療法に適用できないか
次に、金への結合能が高かったいくつかのペプチドに、金イオン溶液を加えてみると、溶液が黄色、赤など、さまざまな色を示しました。これは金の粒子の形状によって表面プラズモン共鳴が異なり、そのため溶液の色も違って見えているからです。それはつまり、ペプチドによって作られる金粒子の形状が違うということを意味しているのです。金への結合能があるペプチドの配列が金粒子の形成に関与し、さらにその大きさや形状が異なるという結果には非常に驚きました(図2)。
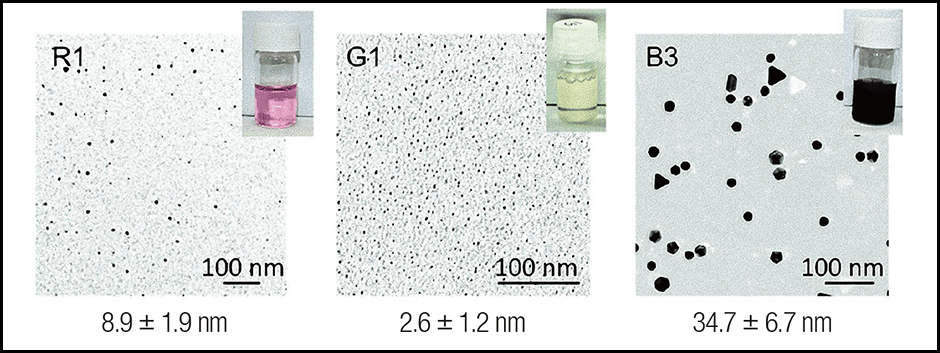
図2 合成されたペプチドによる粒子の違い合成されたペプチドによって溶液の色が異なるのは、結合した金粒子の形状が異なるからと思われる。赤い溶液中の金粒子は約10nm(nmは10億分の1m)、黄色は約2~3nm、青みがかったものは結晶形がプリズムのようなものや十面体の形が見え、粒径も非常に大きい。
粒子形成に大きな影響を与える重要なアミノ酸はHでした。赤や黄色の溶液ではHが多くありますが、金粒子が大きくなる溶液内のペプチドには出現頻度が低いという傾向があったのです。私たちは、こうしてできた粒子のうち、B3というペプチドによって作られた赤外光を吸収する三角金ナノプレートをがんの光温熱療法に適用できないかと考えています。
光温熱療法とは、がん細胞が正常細胞に比べて熱に弱い性質を利用して、光を当てると発熱する光温熱材を投与してがん細胞を死滅させるものです。がんの治療法には、手術、化学療法(抗がん剤など)、放射線療法が知られていますが、患者への負担が少ないことから、この光温熱療法も新しい選択肢として検討されています。この療法に利用する光温熱材として、私たちが合成に成功した金粒子を利用できるのではないかと考えています。
通常、金粒子を合成するときは界面活性剤を用いて結晶制御をしているのですが、光温熱療法など生体に利用するには、安全性が求められます。界面活性剤に比較して、ペプチドは生体親和性があると考えられ、実験では、ペプチドで金粒子を合成すると、界面活性剤の場合よりも細胞の生存率が高いという結果が出ています。
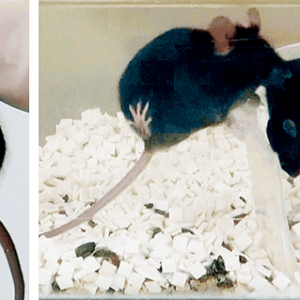
B3ペプチドによって作られた金粒子が近赤外光照射で発熱することを確認した後、これをがん細胞に混ぜて近赤外光を照射する実験を行った結果、細胞が死滅するのを確認しました(図3)。今後、添加するペプチドに、特異的にがん細胞に向かう仕組みが加えられると、実用化にさらに一歩近づきます。
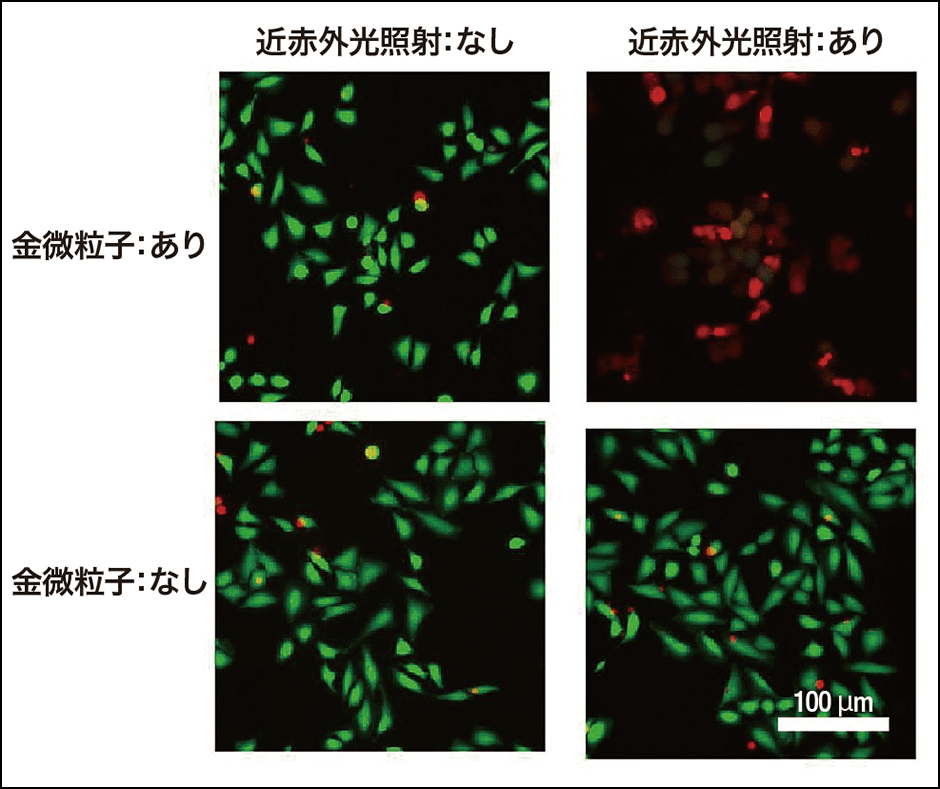
図3 B3ペプチドによって合成した三角金ナノプレートの評価左は近赤外光の照射なし、右は照射あり、上は三角金ナノプレートあり、下は三角金ナノプレートなし。緑は生きている細胞、赤は死んだ細胞を示す。
ペプチドでセンサーを作る
ペプチド合成が「ものづくり」に活用されている例をもう一つ紹介します。ペプチドでセンサーの部品を作るというもので、私たちが参加したのは、名古屋大学の宮田令子先生がプログラム・マネージャーを務めたImPACT(革新的研究開発推進プログラム)の「進化を超える極微量物質の超迅速多項目センシングシステム」です。私たちは、いろいろなデバイスに装着できる分子認識ペプチドプローブ(センサー部品)の設計を担当しました。
ペプチドは、ある程度の分子認識能を持ちつつ、タンパク質のようにすぐに立体構造が崩れてしまうこともなく安定していて、品質管理の観点からも制御しやすいという特徴があります。また自己組織的に表面に修飾したり、化学修飾も可能で扱いが簡便だということから、日常的に使えるセンサーに適用しやすいのではないか、と考えられたのです。
- *1 自己組織的:系全体を統括するようなシステムがないにもかかわらず、全体に秩序だった系をつくること。
プログラムでは、細菌、ウイルス、PM2.5、爆発物、匂い、ストレスマーカーなどあらゆるものを対象にしたペプチドプローブの開発を設計していきました(図4)。
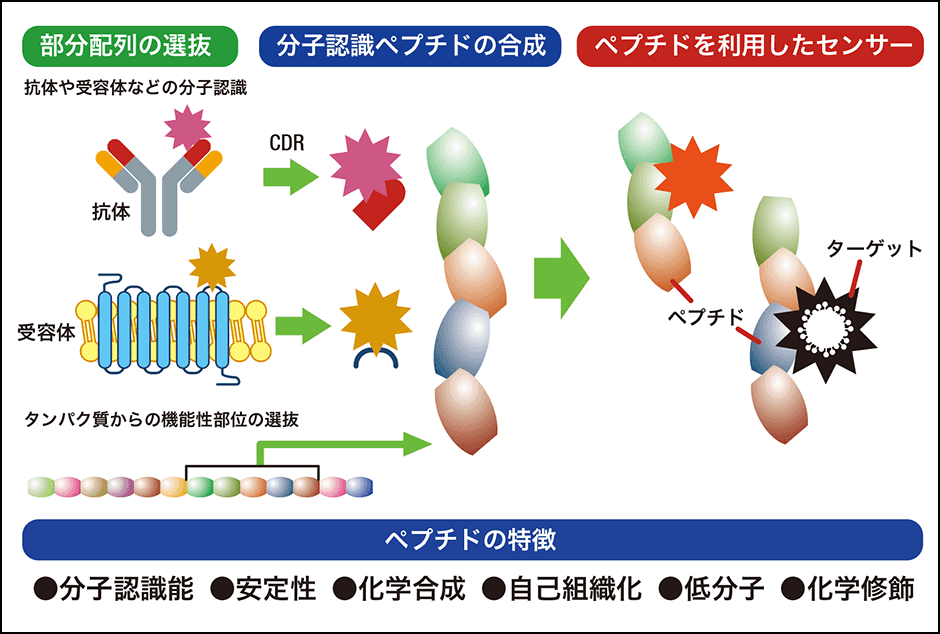
図4 分子認識ペプチドプローブ抗体を参照してターゲットの分子認識能を持つペプチドを設計。センサーに利用しようというもの。
まずウイルスを検知するペプチドです。
ウイルスなどに対する抗体は、非常に分子認識能が高いタンパク質です。抗体の構造で可変領域と呼ばれているところが、抗原特異的に物質を認識する領域として知られており、中でも先端部分の相補性決定領域(CDR)と呼ばれている部分が最も鋭敏に抗原に反応し、アミノ酸を組み替えて抗体を作っている箇所です。その部分のペプチドに分子認識能があると考え探索しました。
最初にインフルエンザのA型とB型を識別するプローブを設計しました。インフルエンザのA型とB型を識別している、ヘマグルチニン(HA)に対して結合性のあるペプチドを設計して、A型かB型かを判別するセンサーの開発を進めています。現在のインフルエンザウイルス検出は、簡易的な検査ではウイルスが生体内で十分に増えないと判別できないことが課題となっていますが、このセンサーを用いると、ウイルスが10個程度も通れば判別率が非常に高くなることが知られており、今よりも早い段階で投薬が始められるのではないか、と期待しています。
細菌と結合できるペプチド
細菌に対して結合できるペプチドを探索するために、微生物をパターン認識するToll様受容体(TLR)を参照しました。グラム陽性菌の細胞壁にしばしば見られる「ペプチドグリカン」を認識するTLR2、微生物の鞭毛を構成するタンパク質「フラジェリン」を認識するTLR5や、グラム陰性菌細胞壁を構成する「リポポリサッカライド(LPS)」を認識するTLR4などの受容体のアミノ酸配列から、それぞれ抗原の認識を担っていそうなペプチド部分を探索したのです。
TLR4を参照してペプチドを合成し、大腸菌との結合性、さらにLPSとの結合性を調べると、結合が見られた配列は、両者のターゲットをそれぞれ非常に高く認識しているということが示唆されました。
このペプチド探索の最終的な目的はデバイスのプローブですから、センサー本体と合体した際に実際に機能することも重要です。
今回は窒化ケイ素の膜の表面の穴に微生物を流し、電流値の差を見る実験を行いました(図5)。ポアセンサー(センサー装置)は、大阪大学産業科学研究所の筒井真楠准教授、谷口正輝教授、川合知二招聘教授、鷲尾隆教授との共同研究により、作製していただきました。例えば、微生物の鞭毛のタンパク質、フラジェリンを認識する合成ペプチドを、この穴の内側に設置し、野生株の大腸菌と、フラジェリンが欠損した大腸菌を通すと、センサーは野生株の大腸菌に強く反応することがわかりました。このように、ターゲットの特徴に応じてペプチドを設計し、目標物を検知することができるのです。
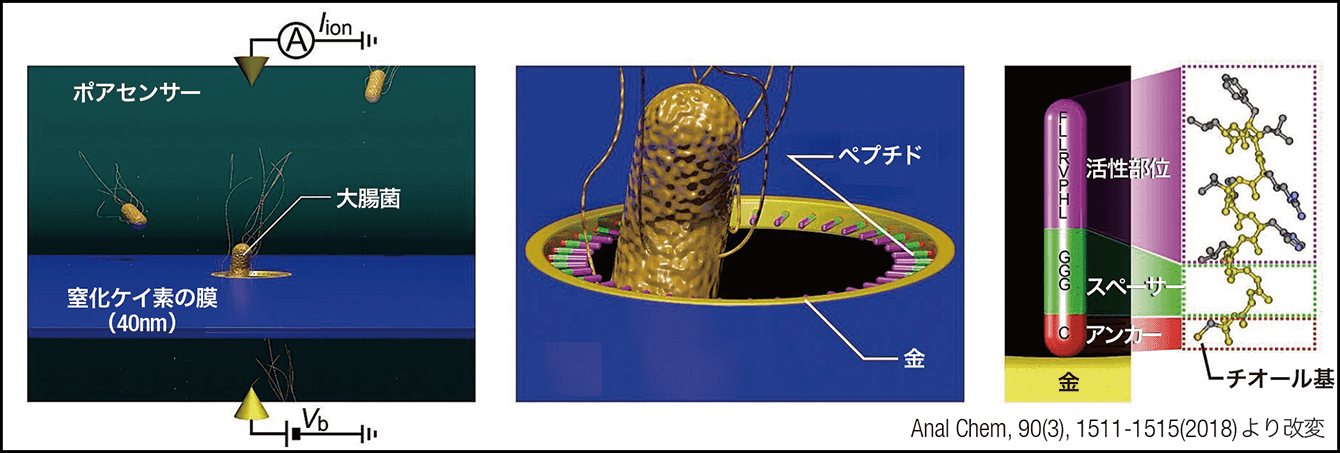
図5 センサーの仕組みポアセンサーの穴に菌などターゲットが通る。穴に設置されたペプチドプローブは、内側にターゲットを認識するペプチド、穴側は使われている素材と結合するペプチド、中央にその2つをつなぐペプチドという構成。
がんのエクソソーム(細胞外小胞)のセンサーも名古屋大学の安井隆雄准教授、馬場嘉信教授との共同研究により開発中です。
がん細胞から放出されるエクソソームは、早期に血管に入り行き着いた先で、自身に含まれるシグナル因子が受け皿となってがん細胞の転移を助けるように働くので、これをがんの診断や転移予測、術後の予後診断の他、最近は治療にも利用できるということで注目されています。そのエクソソームを認識するペプチドを設置したセンサーで、エクソソームの診断デバイスを作れるのではないかと考えています。
エクソソームのマーカータンパク質としてCD9(テトラスパニンの一つ)が知られており、例えばそれを認識するペプチドを設計して装置に設置します。実験では、しっかりとエクソソームを検知している様子も見られました。
抗体を用いた検査も可能ですが、エクソソームとの相互作用が大きく、捕捉したエクソソームの溶出が難しいという問題があります。ペプチドの場合は、他の生体成分を低減したエクソソーム濃縮液を採取できるのが利点です。
またこのCD9結合ペプチドは、将来、診断だけでなく治療にも展開できるのではないかと考えています。というのも、ここで合成したCD9結合ペプチドは、CD9の機能を阻害したり、機能を変えられる可能性があるからです。がん細胞を密に生やしたプレートにこのCD9結合ペプチドを添加すると、その部分で濃度依存的にがん細胞の移動が抑制される実験結果も出ています。つまりこのペプチドは、エクソソームのマーカーであるCD9が高発現している細胞において、細胞の移動や浸潤能を抑制できそうだということがわかってきています。
微細加工を施したさまざまなデバイス
ペプチドが利用できるのは、生物に対するセンサーのプローブだけではありません。九州大学の都甲潔先生が爆発物を認識する抗体を作成され、それを使ったセンシングシステムを開発していますが、その抗体中でトリニトロトルエン(TNT)を認識している部位を調べました。その際に見つけたペプチドを利用してTNTを検出できることもわかりました。
DNAのアプタマーも、酵素や受容体、ウイルスのタンパク質などに結合する他、金属イオンとも結合するので、DNAがさまざまな分子を認識する仕組みを応用して、センサーの認識装置にする研究も進んでいますが、ペプチドも同じような使い方ができると考えています。むしろ、DNAより利用できるアミノ酸の数が多く、バラエティのある認識能が発揮できるのではないかと期待しています。
- *2 アプタマー:特定の物質と特異的に結合する核酸。細胞やタンパク質の機能を阻害する。
ナノテクノロジーにより、微細加工を施したさまざまなデバイスが作られているのですが、表面が生体親和性を持ちにくいという課題があります。ですから、バイオセンシング(生体分子を対象としたセンシング)においては、その界面をどのように構築していくかが非常に重要なポイントです。ペプチドは、いろいろな物質を検出するセンシング分子として利用でき、扱いやすいということからも、今後、界面分子としての機能が果たせるのではないかと期待されています。