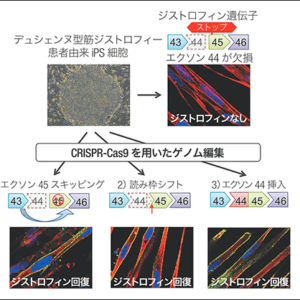
ゲノム編集は、ゲノム編集ツールであるDNA切断酵素を使い、塩基配列を特異的に切断することで遺伝子を操作する技術だ。外来遺伝子を挿入する遺伝子組換えとは異なり、その生物の遺伝子を改変するための安全性が比較的高いとされ、さまざまな分野で普及している。この発展をもたらしたのが、革新的なゲノム編集ツールといわれるCRISPR-Cas9。開発者は2020年、ノーベル化学賞を受賞している。ゲノム編集技術でなければできない「ものづくり」の可能性は広がっている。
特集 ゲノム編集の真実 〈巻頭インタビュー〉
革新的な「ツール」がもたらす多様な「ものづくり」の可能性
構成/渡辺由子 イラストレーション/千野六久
1990年代後半、ゲノム編集技術は、従来の遺伝子組換えの代替技術として登場しました。私の専門は発生生物学で、モデル生物のウニを研究対象に、生きた卵で細胞の分化過程を調べていました。2007年ごろに、ウニの胚の中で遺伝子の発現量の変化を追跡するツールとして、ゲノム編集の第1世代「ZFN(ジンクフィンガー・ヌクレアーゼ)」に着目。ZFNの受託作製は高額だったので、独自にZFNの作製に取り組み、2~3年かけて成功させ、2010年に論文発表しています。
同年には、ZFNよりも改変しやすい、第2世代の「TALEN(ターレン)」が発表されます。私たちの研究グループは、より活性が高く、簡便なTALENを独自に開発し、「プラチナTALEN」と名づけました。作製システムも開発し、さまざまな生物の遺伝子改変が可能になり、魚の育種、医療にも活用されています。
この頃から、ゲノム編集技術に興味のある研究者や、広島大学で技術を習得したい研究者に向けた研究者コミュニティをつくり、ゲノム編集技術の最新技術の共有や、社会受容についての議論を活発化し、海外との連携や強化も進めてきました。その発展形が、2016年にスタートさせた日本ゲノム編集学会で、3期6年、会長を務め、現在は東京大学医科学研究所の真下知士教授に引き継がれています。
独自のゲノム編集ツールの開発
2012年、第3世代の「CRISPR-Cas9(クリスパー・キャスナイン)」が発表されます。操作が簡便で、しかもピンポイントで遺伝子の機能の欠損(ノックアウト)ができる、革新的な遺伝子改変ツールです。専門家でなくとも使いやすく、基礎研究の分野だけでなく、農業、創薬・治療、バイオものづくり、環境など、さまざまな分野での研究・開発に活用され、生命科学研究に大きな発展をもたらしています。
今や基礎研究において、CRISPR-Cas9は必須のツールです。基礎研究であれば、世界中の誰もが自由に使えるよう、安価な使用料で提供されており、その約束事は現在も守られています。
しかし、CRISPR-Cas9の知的財産の特許権は複雑で、ある企業が産業利用を目的に使って利益を上げようとすると、高額な特許使用料を支払わなければなりません。例えば、医薬品開発のために、CRISPR-Cas9で細胞の遺伝子改変を行うには、100億円を超える特許使用料が発生するといわれており、CRISPR-Cas9の産業利用を進める障壁となっています。
日本をはじめとする国内外の研究機関で、独自のゲノム編集ツールの開発が進められています。しかし、CRISPR-Cas9をはるかに超えるような技術でなければ、もはや特色を出せない時期に来ており、激烈な競争には勝てません。それでも、CRISPR-Cas9改良版をはじめとするゲノム編集技術の情報が、毎日のようにインターネット上で公開され、ゲノム編集の技術開発のスピードの速さと、影響力の大きさを実感しています。
CRISPR-Cas9は優れた技術ですが、万能ではなく、標的配列と類似した配列を誤って切断し、予期せぬ箇所へ変異導入が起こる「オフターゲット作用」があります。この弱点を考えると、本学発のプラチナTALENであれば、オフターゲット作用の回避も可能になるなど、TALENのほうが良い場合もあります。基礎研究ではCRISPR-Cas9を使用し、産業利用には高額な特許使用料の心配がない、安価なZFNやTALENを使用、というような使い分けが有効だと考えています。
本学では、CRISPR-Cas9を超えるゲノム編集ツールの開発から方向を変え、特定の生物種の遺伝子改変においてゲノム編集技術の活用を目指すとともに、いかに正確に遺伝子改変を実行できる技術開発を進め、ゲノム編集の素晴らしい技術を使って、人々と環境に良い影響をもたらす「ものづくり」を目指しています。
本学には、ゲノム編集技術が日本に導入された初期から携わってきた豊富な人材がそろい、ノウハウが蓄積されています。2019年には、ゲノム編集技術の開発と生物のゲノム情報の解析・分析の両方の機能を持った、本学発ベンチャー企業「プラチナバイオ」を立ち上げました(図1)。事業会社からの依頼と投資を受け、目的に最適化したゲノム編集技術を提供しており、多くのプロジェクトや共同研究を進めています。さまざまな分野の研究者がゲノム編集技術に適応し、研究を迅速に進められるように、最良のコンサルティングと、確かな技術の提供を目指していきたいと考えています。
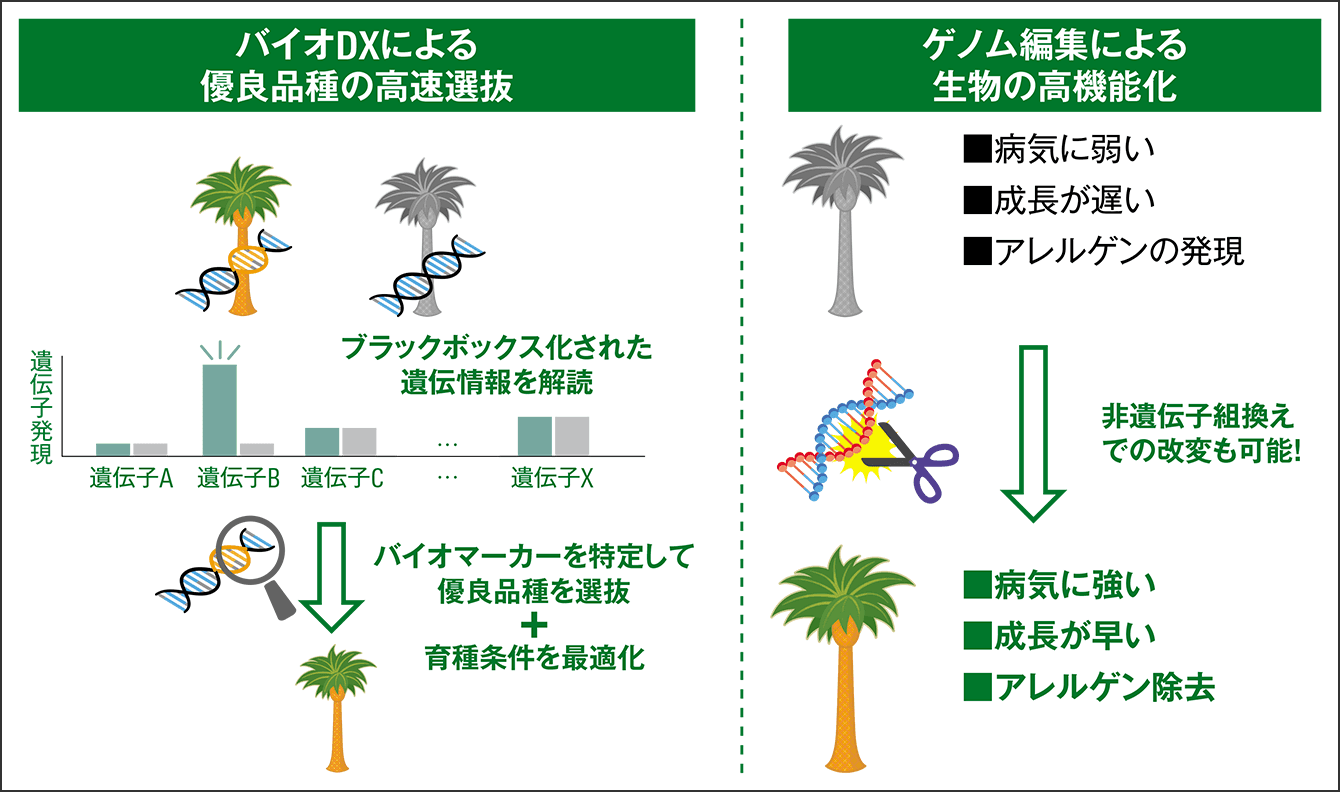
図1 広島大学発ベンチャー企業「プラチナバイオ」のソリューション独自のAIやビッグデータなどを活用したバイオDX(Digital Transfor-mation)により、長い年月が必要だった優良品種選抜の期間短縮や、最先端のゲノム編集技術をもとに、生物の高機能化を実現。社会課題の解決を目指す。
ゲノム編集技術によって、機能性成分が高蓄積したトマトや肉厚のタイなど、付加価値を高めた食品が上市されつつあり、私たちの研究グループが携わったゲノム編集食品も、2、3年後の上市を目指しています。本学大学院統合生命科学研究科の堀内浩幸教授らと、食品大手企業との共同研究で、プラチナTALENで遺伝子改変を行い、アレルギーの主要な原因物質(アレルゲン)のない卵「アレルギー低減卵」の開発です(図2)。
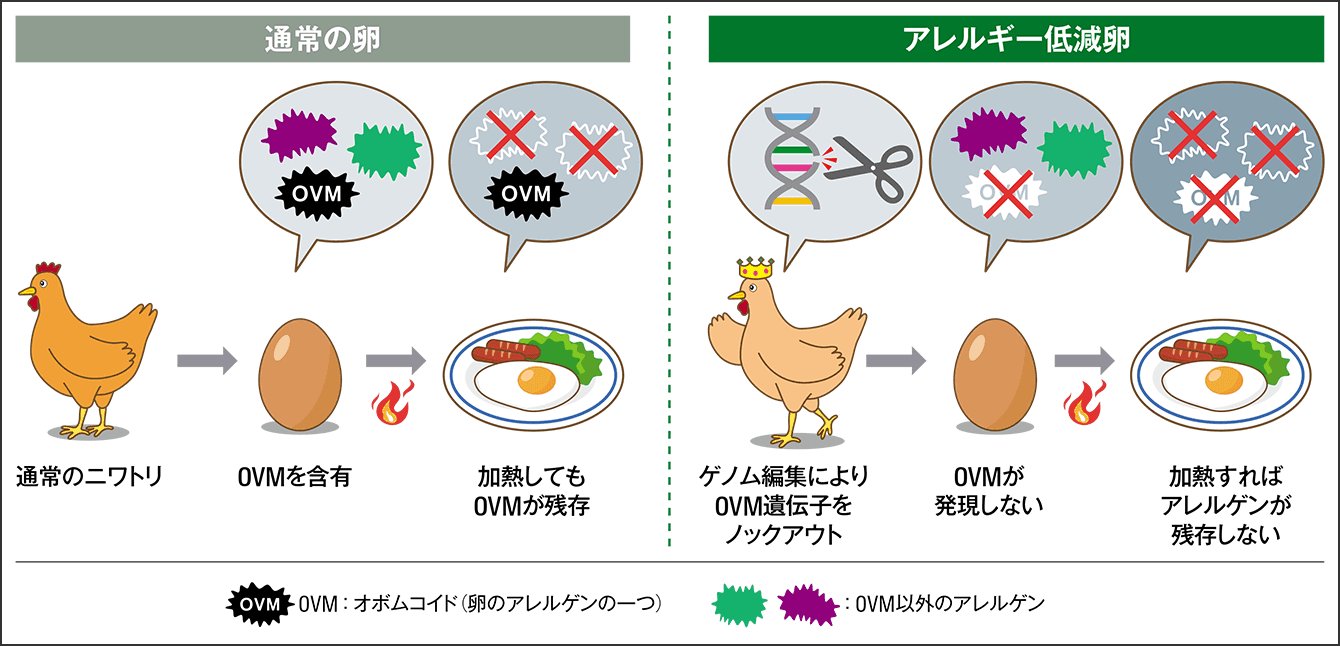
図2 通常の卵とアレルギー低減卵との比較卵のアレルゲンの一つであるOVMは、加熱や消化酵素を用いた加工にもアレルゲン性は失われない。ゲノム編集ツールで、OVM遺伝子をノックアウトしたニワトリを作製し、そのニワトリが産んだ卵にはOVMが含まれないことを確認した。2、3年後の上市を目指し臨床研究が進む。
卵アレルギーは、日本で最も多い食物アレルギーで、生まれてくる子どもの約10%に卵アレルギーがあるという研究報告もあります。卵の主なアレルゲンは、オボムコイド(OVM)、オボアルブミン、オボトランスフェリン、リゾチームで、OVM以外は熱に弱く、十分な加熱でアレルゲン性が低下します。しかし、OVMは熱や消化酵素に対して非常に安定的で、水溶性であるため、加熱しても、消化酵素を用いて加工しても、アレルゲン性は失われません。
アレルギー低減卵の開発
堀内教授は、以前よりニワトリの研究を続けていて、卵アレルギーに悩んでいる人が多いことに問題意識を持ち、アレルゲンを取り除いた卵の作出に挑戦し続けていました。2013年からは、食品会社との共同研究でプラチナTALENを使い、OVMが含まれない卵の研究開発を進めました。
まず、プラチナTALENでOVM遺伝子をノックアウトしたニワトリを作製し、次にOVMノックアウトニワトリが産んだ卵にはOVMが含まれていないことを確認しました。また、ゲノム編集により心配される変異タンパク質は生産されておらず、親ニワトリも卵も外見的な異常はなく、オフターゲット作用についても全ゲノム情報を解析して何も確認されませんでした。
このように、OVMノックアウト卵(アレルギー低減卵)の安全性が示されたことから、現在は応用研究フェーズに入り、卵アレルギー患者に対する安全性を確認するために、国立病院機構相模原病院と連携して臨床研究を行っています。専門医による監督の下、OVMによる卵アレルギー患者17人に対して、加熱して粉末化したアレルギー低減卵を試験食とした経口負荷試験を実施。経過観察から、17人全員にアレルギー反応は確認されませんでした。この臨床研究は、摂取量を段階的に増やすなど、2026年を目安に症例数を重ねる予定です。
アレルギー低減卵の開発については、2022年から、科学技術振興機構(JST)の「共創の場形成支援プログラム(COI-NEXT)」で「本格型」に採択されている、「Bio-Digital Transformation(バイオDX)産学共創拠点」のプロジェクトの一つとなり、JSTから資金を得て運営しています。バイオDX産学共創拠点は本学が代表機関となっており、私はプロジェクトリーダーを務めています。
なお、バイオDX産学共創拠点は、バイオDXの推進により、誰一人取り残さず、持続的な発展を可能とするバイオエコノミー社会の実現を目指し、ゲノム編集技術と、遺伝子情報の解読・解析を行うデジタル技術の両輪を動かし、生物の持つ機能を最大限に引き出して、食物・健康・エネルギーなどの直面する課題を解決しようとするものです。
医療面での共同研究では、iPS細胞による網膜再生医療の研究開発をリードする、ビジョンケアの代表取締役社長CEO・髙橋政代博士の研究グループと共に、遺伝性網膜変性疾患の治療法の開発に挑んでいます。
この疾患は、遺伝子変異が原因で、視細胞や網膜色素上皮に進行性の変性を示し、死滅に至ります。なかでも最も多い網膜色素変性症は、中途失明の原因の一つで、世界で約150万人の患者がいると推定されています。現在、根本的な治療法は確立されておらず、血流改善薬やビタミン剤などの薬物療法や、遮光眼鏡などの補助器具の使用といった、進行を遅らせることを目的とする対症療法しかありません。
進むゲノム編集技術への社会需要
網膜色素変性症のあるタイプでは、ゲノム編集技術による治療法が期待されており、私たちの研究グループとの共同研究が始まりました。高い特異性を持つZFN(ZF-ND1)の効率的な設計方法を開発し(図3)、成体の視細胞でCRISPR-Cas9と同等の切断効率を達成することができました。また、ZFNはCRISPR-Cas9やTALENよりも分子量が小さく、アデノ随伴ウイルスベクターで送達する遺伝子導入手法を確立できると考え、さらに研究を進めています。
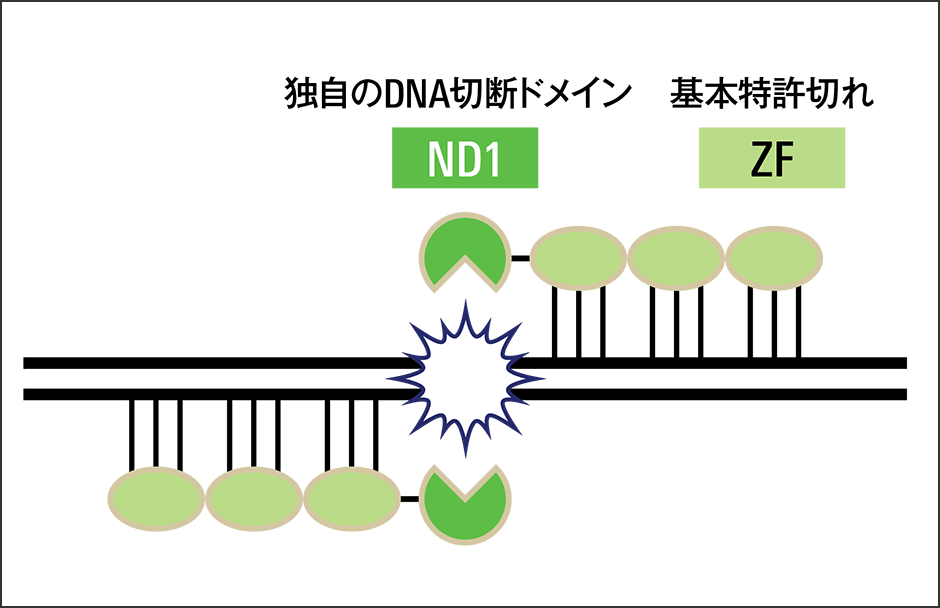
図3 広島大学開発のゲノム編集ツール「ZF-ND1」第1世代「ZFN」のDNA切断ドメイン「ZF」は基本特許切れで、ライセンスフリーで使用できる。山本教授らは、独自開発のDNA切断ドメイン「FirmCutND1」を組み合わせた、純国産ゲノム編集ツール「ZF-ND1」を作成。高額なライセンス料の回避により、産業利用が加速するだろう。
このように、ゲノム編集技術によるさまざまなチャレンジが、国内外で続けられていますが、日本では、遺伝子組み換え食品に対する拒否感が依然として根強いと見ています。その原因を考えると、遺伝子組換えについての丁寧な説明や、研究者や事業会社の関係者だけでなく、社会学者や市民団体といったさまざまなステークホルダーの方たちとの議論が十分にできていなかったために、誤解が生じてきた経緯があります。
そもそも、ゲノム編集技術は遺伝子組換えとどう違うのか、と懐疑的な意見を持つ方が少なくありません。放射線を当てて自然突然変異を起こす育種の技術がありますが、変異が入っている無数の箇所から、有効な1つの箇所の変異を取り上げて品種改良を進めます。ゲノム編集は、1つの箇所を狙って改変できるので、科学的にはゲノム編集のほうが安全だといえます。私たち研究者は、「他の生物のDNAが入っているような生物を市場には決して出さない。安全性をしっかりと確認したものしか出さない」といった説明を、丁寧に行う努力をしていますが、より一層の努力が必要だと感じています。一般の方々に、きちんと伝え、理解していただくことで、ゲノム編集技術への社会受容が進み、産業利用が広がっていくと考えています。
一方で、アレルギー低減卵のように、ゲノム編集技術によって、卵アレルギーで悩む子どもたちを救えるのは、非常に意義のあることだと考えます。「ゲノム編集技術でなければできなかった、ずっと切望していたもの」をつくることにより、社会受容の高まりにつながると考えています。これは、ゲノム編集技術に携わった当初からの変わらぬ信念です。
ゲノム編集技術が高付加価値を与えるツール、という点で、ゲノム編集を行うことで「成長が早い」「たくさん収穫できる」のは、消費者メリットではなく、生産者メリットでしかありません。消費者が考える付加価値の中でも、特にゲノム編集技術でなければできなかったものをつくることにより、消費者が新しい技術を受け入れ、メリットを享受できると考えています。その第1号に位置付けているのが、アレルギー低減卵なのです。
また、これまでにない大規模災害など、その原因となる気候変動には驚くばかりですが、農作物に関して見ると、これまで日本で育ってきた農作物が育たなくなる気候になっています。今後は高温や乾燥に耐性を持った品種改良が必要になり、こういうときこそ、ゲノム編集技術を使うことが大きなポイントになります。
気候変動を招く環境問題に対しても同様です。石油などの化石資源に頼ることのないエネルギーをつくり出す方法として、ゲノム編集技術を使った微生物によるエネルギー生産についても、一日も早く成功させたい課題です。
ゲノム編集技術は、もはや1つの道具です。道具を自在に使いこなして、人類が直面している社会課題の解決にチャレンジしていきたいと考えています。