
「肥満」と腸内フローラ異常に関する学術文献数は年次ごとに右肩上がりに増えていることをターンボー博士が報告している(図)。この状況は、本コラムが開始された2018年から現在まで全く同様であり、我々の健康と腸内フローラに関する学術研究の進展を象徴している。
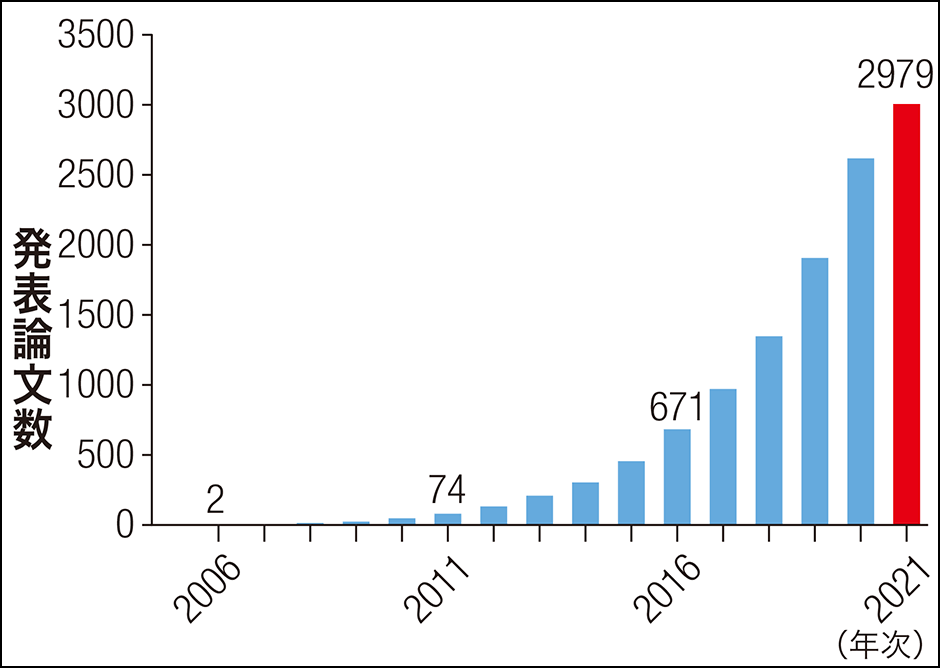
図 食事性肥満と腸内フローラに関する学術論文数(累積)の年次推移ターンボー博士の論文に記載された検索式を用いて筆者が算出した結果を示す。
2021年は7月現在の数字
「第25回日本がん免疫学会総会」(2021年7月1~3日:和歌山県)に参加し、がんに対する免疫療法の最新情報を学んだ。特に、がんに対する生体の免疫機構のブレーキを解除して腫瘍免疫が効果的に働くことを狙った「免疫チェックポイント阻害剤(ICI)」は、さまざまながん種に臨床応用されており、一部の患者さんには著効を示すこともあって、大きな期待が寄せられている。一方で、抗がん化学療法に比べると頻度は低いものの有害事象(免疫関連有害事象)が認められるともされている。同学会ではシンポジウム「がん免疫療法における腸内細菌の意義」に演者としても出席した。「腫瘍の微小環境」に浸潤する免疫細胞の数や機能が、腫瘍の増殖に大きな影響を与えるが、このところ、「バクテリアルトランスロケーション(BT)」を介して腸内から生体内に侵入したさまざまな腸内細菌が腫瘍局所に集積し、腫瘍に対する免疫細胞の機能に影響を与えることを示唆する学術報告が相次いでいる。特に、抗がん化学療法やICIの投与は腸管上皮のバリア機構を緩めてしまい、腸内微生物のBTを促進する。実験動物モデルを用いたいくつかの学術報告では、生体内に侵襲してさらに腫瘍局所に集積した微生物の種類によって、抗がん剤やICIの作用を増強するか抑制するかが明確に異なってくること、このうち、Bifidobacterium bifidumなどのビフィズス菌は腫瘍局所の抗腫瘍免疫を促進することが報告されている。ビフィズス菌により産生されるイノシンが抗腫瘍免疫を促進すること、抗腫瘍作用を発揮するビフィズス菌では細胞壁のペプチドグリカン合成が顕著であること、など多様な作用メカニズムが示唆されている。腫瘍局所における抗腫瘍免疫応答において、近年、「炎症性腫瘍(hot tumor:HT)と非炎症性腫瘍(cold tumor:CT)」の概念が唱えられている。すなわち、HTでは抗腫瘍免疫応答を担う免疫細胞が腫瘍に浸潤して抗腫瘍作用を発揮しているのに対し、CTでは免疫細胞の腫瘍浸潤の程度が低く、免疫応答も弱い、というものである。BTを介して腫瘍に集積する微生物の種類はさまざまであるが、腫瘍微小環境における腸内微生物も加味した効果的な免疫制御方法の開発が今後の課題であろう。
- 注1) バクテリアルトランスロケーション:腸管腔の腸内細菌が腸管壁を介して生体内に侵入すること。
- 注2) イノシン:肉類に多く含まれるヌクレオシド(塩基と糖が結合した化合物)の一種。
- 注3) ペプチドグリカン:細菌の細胞壁の構成成分で、ペプチドと糖が網状構造を形成する高分子化合物。
日本医療研究開発機構(AMED)は2015年に発足した内閣府の国立研究開発法人であり、医療分野の研究開発を総合的に推進する司令塔として機能している。AMEDが推進する第2期の革新的先端研究開発支援事業のシーズ開発・研究基盤プロジェクト(2015~2027年度)の研究開発領域の一つとして、「微生物叢と宿主の相互作用・共生の理解と、それに基づく疾患発生のメカニズム解明」が進められている。さらには、上記の基礎研究の段階から、より応用的な「腸内マイクロバイオーム制御による次世代創薬技術の開発」が開始されることになっている。このようなAMEDプロジェクトに参画する研究者には充実した研究予算と期間が保証されるが、公募制で競合もある。いずれにしろ、前段の肥満やがん免疫のみならず、さまざまな医療領域における腸内微生物の関わりに大きな注目が寄せられるようになったものと実感している。ちなみに、筆者は今春より「AMED課題評価委員」の職を仰せつかっており、慣れない業務に戸惑いながらも多くの勉強ができて嬉しく感じているが、職務の詳細は開示してはならないことになっている。
- *1 Turnbaugh PJ. Microbes and diet-induced obesity: fast, cheap, and out of control. Cell Host Microbe, 21: 278–281, 2017. doi:10.1016/j.chom.2017.02.021.
- *2 第25回日本がん免疫学会総会HP. http://www.congre.co.jp/25jaci2021/
- *3 Nejman D, Livyatan I, Fuks G, et al. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science, 368: 973-980, 2020.
- *4 Riquelme E, Zhang Y, Zhang L, et al. Tumor microbiome diversity and composition influence pancreatic cancer outcomes. Cell, 178: 795-806, 2019.
- *5 Luo B, Zhang Y, Zhang C, et al. Intestinal microbiota: A potential target for enhancing the antitumor efficacy and reducing the toxicity of immune checkpoint inhibitors. Cancer Letters, 509: 53-62, 2021.
- *6 Shi Y, Zheng W, Yang K, et al. Intratumoral accumulation of gut microbiota facilitates CD47-based immunotherapy via STING signaling. J Exp Med, 2020 Vol. 217 No. 5 e20192282.
- *7 Mager LF, Burkhard R, Pett N, et al. Microbiome-derived inosine modulates response to checkpoint inhibitor immunotherapy. Science, 369:1481-1489, 2020. doi: 10.1126/science.abc3421.
- *8 Lee SH, Cho SY, Yoon Y, et al. Bifidobacterium bifidum strains synergize with immune checkpoint inhibitors to reduce tumour burden in mice. Nat Microbiol, 6:277-288, 2021. doi: 10.1038/s41564-020-00831-6.
- *9 van der Woude LL, Gorris MAJ, Halilovic A, et al. Migrating into the tumor: a roadmap for T cells. Trends Cancer, 3:797-808, 2017. doi: 10.1016/j.trecan.2017.09.006.
- *10 Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature, 541: 321-330, 2017.
- *11 国立研究開発法人日本医療研究開発機構HP. https://www.amed.go.jp/koukai/index.html.















