ロベルト・コッホは「感染症は細菌が原因」としたが、当時知られていなかった、細菌より小さな存在がウイルスだ。ウイルス(virus)はラテン語で「毒液」のことで、ウイルス=悪者というイメージは新型コロナウイルス感染症ですっかり定着してしまった。しかし、ゲノム解析の進歩により、内在性レトロウイルスなどさまざまなウイルスが、多くの生物の進化に関わっていることがわかってきた。従来の定義に当てはまらないウイルスも見つかっている。新たなウイルス像が生まれつつある。
特集 知られざるウイルス 〈巻頭インタビュー〉
生物の進化にも関与——ウイルスは何者なのか
構成/飯塚りえ イラストレーション/青木宣人
1876年、初めて炭疽菌の単離に成功したコッホは「感染症は細菌によるもの」と提唱しました。この発見に役立ったのが、陶器でできた濾過器でした。0.2㎛ほどの陶器の細かい孔は、細菌を通さず捕獲することができたのです。
ところが、感染症の原因としてこの装置を通り抜けてしまうものが見つかりました。これがウイルス(ラテン語で「毒液」の意味)と名づけられたのです。このときからすでに「悪者」でした。
自己複製せず寄主の細胞内でのみ増殖
しかし分子生物学など科学の手法が発達してウイルスのさまざまな振る舞いがわかった現在、ウイルスとは一体何なのか、という問いが生まれています。
教科書的に言えば、ウイルスは、遺伝情報の入ったDNAあるいはRNAといった核酸とそれを包むキャプシドと呼ばれるタンパク質の殻という構造を共通して持っています。一方、生物の基本単位とされる細胞構造やタンパク質合成のためのリボソームは持ちません。大きさは、一般には20~300nm(1nm=0.001㎛)程度で、単独では自己複製できず、寄主の細胞内でのみ増殖するとされています。核酸とキャプシドという構成要素は同じでも形はさまざまで、球状のもの、棒状のものなどあります(図1)。これにエンベロープという付加的な構造を持つものもあります。エンベロープは核酸とキャプシドを包む脂質二重膜ですが、膜自体はウイルスが作り出すものではなく、感染した細胞から出るときに、寄主の細胞膜等を拝借する形で作ります。コロナウイルスもキャプシドの外側にエンベロープを持っています。
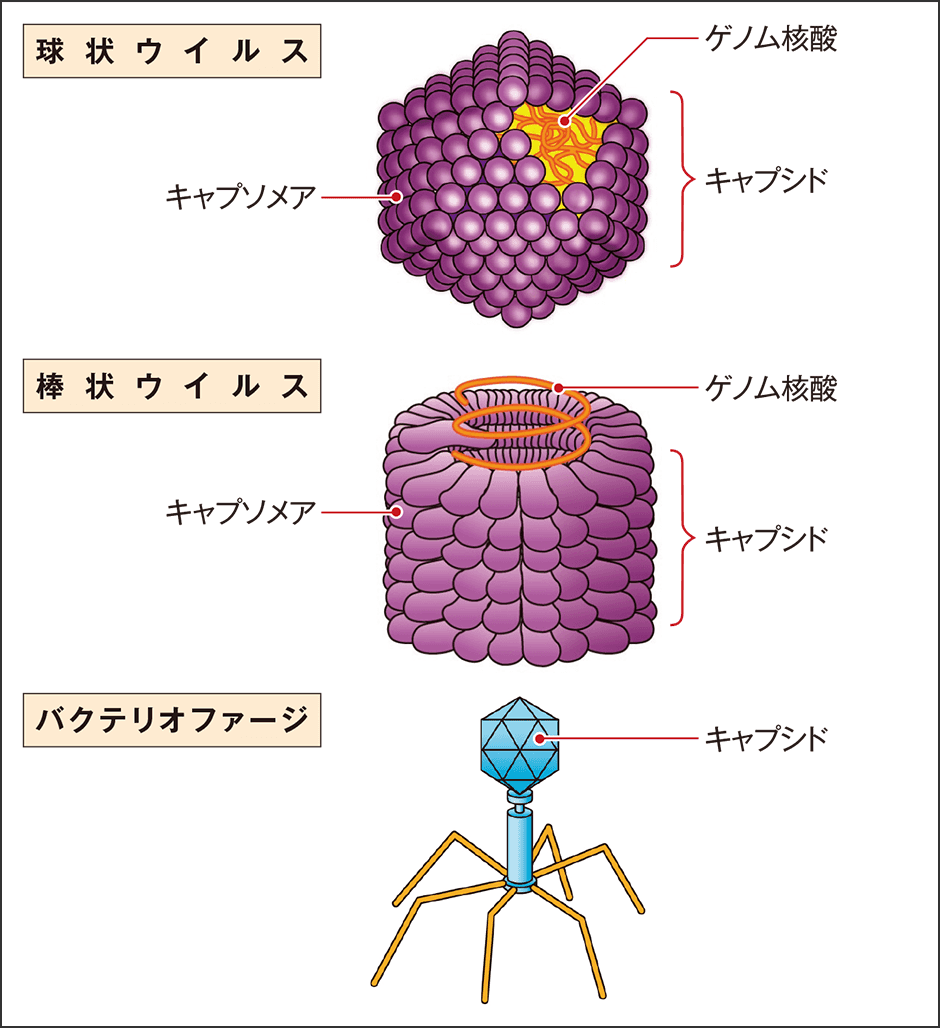
図1 さまざまな形のウイルスウイルスと一口に言っても、球状(正20面体)、棒状、ひも状など、さまざまな形がある。
地球上にはいろんなウイルスが存在しており、その分類は1966年に発足した国際ウイルス分類委員会(ICTV:International Committee on Taxonomy of Viruses)が行っています。現在、ICTVがウイルスの仲間として認めているものの中には、これまでの教科書的な説明の枠をはみ出て、RNAだけでキャプシドを持たないウイルスや細菌と同程度のサイズを持つウイルスなどが加えられています。
キャプシドのないウイルス種は植物や真菌でよく見つかります。なぜウイルスの仲間とされるかというと、自身のRNAを複製するための酵素の特徴が、実際にキャプシドを作るウイルスとよく似ており、親戚だと考えられるからです。つまりキャプシドレスのウイルスは、キャプシドを持つウイルスが退化した、あるいはその祖先だったと考えられているのです。例えば、コロナウイルスの場合、次の寄主の細胞に移るために細胞外に出ていくというサイクルがあり、このようなとき、キャプシドは紫外線や核酸の分解酵素など外部の環境から核酸を守る役割があります。
時代によって変化するウイルスの基準
しかしキャプシドレスのウイルスの多くは、一度寄主の細胞に入ったら基本的に外に出ることがなく、そのためキャプシドを持つ必要がないのでは、と考えられています。新しい特徴を持ったウイルスが登場するたび、ICTVがその分類をしますので、「ウイルス」の基準も時代によって変化しています。
例えば転移因子(トランスポゾン)は、ウイルスとの境界がかなり曖昧だといえる存在です。トランスポゾンは、核内の特定のゲノム配列が他の場所に挿入されたり、コピーを増やしたりする因子の総称で、生物ゲノムにはほぼ例外なく存在しているのですが、このうち、LTRレトロトランスポゾンと、ヒト免疫不全ウイルス(HIV)などで知られるレトロウイルスのグループは、非常に似通った遺伝子と構造を持っています(図2)。
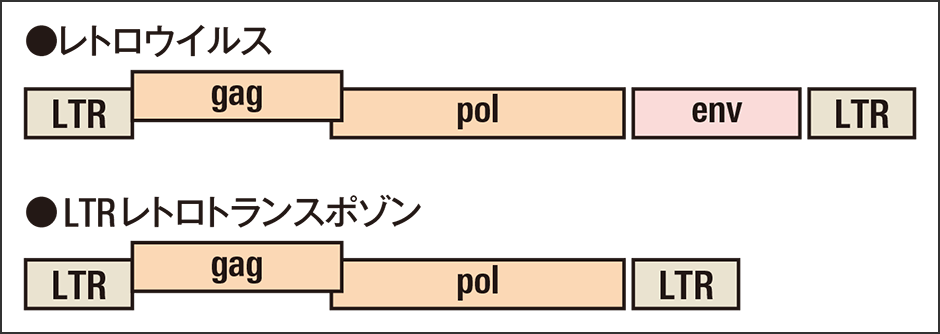
図2 レトロウイルスとレトロトランスポゾンの模式図2つの違いは、エンベロープを作るenvの有無のみで、他の部分は同じ。
レトロウイルスはエンベロープを作る遺伝子を持っていますが、典型的なLTRレトロトランスポゾンにはありません。しかし先に触れたように、細胞外に出ることのないウイルスには、キャプシドもエンベロープも持たないものもあります。同時に、生物のゲノム内には、エンベロープ遺伝子が破壊され、機能しなくなったレトロウイルスが多く見つかります。仮にエンベロープの有無でウイルスとトランスポゾンを分類すると、これらのレトロウイルスはトランスポゾンに分類されることになってしまいます。
例えばコロナウイルスとHIVとLTRレトロトランスポゾンの3つを並べたとき、感染症を起こすとしてHIVとコロナウイルスがウイルスという同じ分類になりますが、塩基配列だけを見たら、どんな科学者でもLTRレトロトランスポゾンとHIVを仲間にし、コロナウイルスはかなり離れたところに分類するでしょう。
また、細菌等では「プラスミド」という核酸因子が見つかっています。プラスミドは染色体とは独立して、細胞質で増殖するので、ウイルスに似たところがあるのですが、抗生物質の耐性遺伝子を持っていたり、細胞間の遺伝子伝達に役立つなど、細菌のほうにも利益を与えています。ある意味、細菌と共生しています。プラスミドは細胞の増殖とともに自己を維持する戦略を取っているといえます。
キャプシドレスのウイルスは、これまでにウイルスと定義されたものと塩基配列が似通っているためにウイルスとして分類されているのですが、プラスミドの中にも、ウイルス遺伝子と同祖と思われる遺伝子配列を持つものがあります。同じ考え方を適用するなら、これらのプラスミドはウイルスということになります。
こうして、一見すると矛盾があるように思えるウイルスの定義には科学の歴史が関連していると思われます。
ウイルスの驚くべき作用
ウイルスは、生物に病気を起こすということから研究が進み、1898年にタバコモザイクウイルス、1901年にはヒトの黄熱ウイルスも見つかりました。プラスミドは染色体外の遺伝因子として、その概念が提唱されたのは1950年代。そこから薬剤耐性や性の決定因子として働く役割が注目されてきました。トランスポゾンも他の遺伝子の働きを制御する「動く遺伝子」として、1950年代にその存在が提唱されました。つまり全く違うものとして見つかったのですが、技術と科学の深化によって、これらの共通性が徐々にわかってきたという状態ではないでしょうか。ウイルスの定義はなかなか手ごわいのです。
また、ウイルスは「無生物」とされていますが、驚くような生態的意義を持っているウイルスもあります。
寄生バチの仲間、コマユバチは、アワヨトウという寄主に産卵するのですが、コマユバチが幼虫となって脱出する際、寄主のアワヨトウは目に見えて奇妙な行動を取るようになります(図3)。
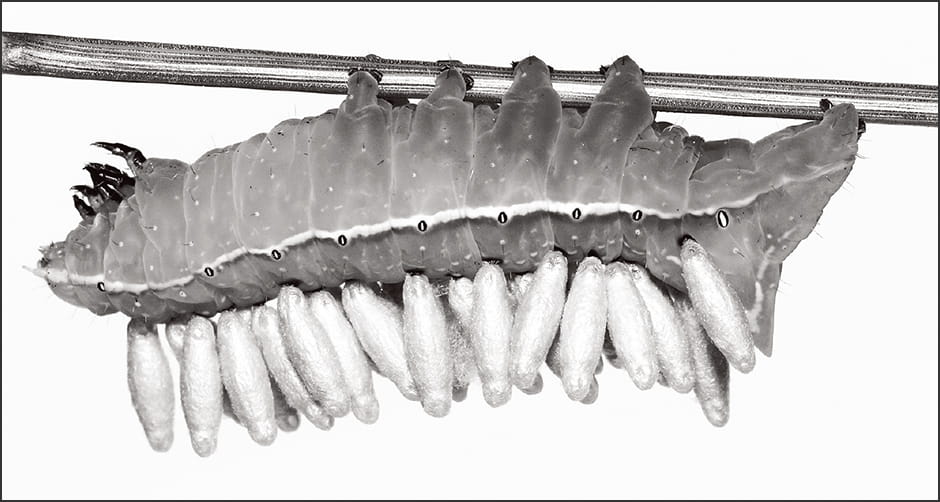 (写真提供:杉浦真治)
(写真提供:杉浦真治)
図3 寄主から脱出した寄生バチの幼虫寄主(オオシマカラスヨトウ)の背で寄生バチ(サムライコマユバチ)はサナギとなる。寄主はあたかもウイルスにコントロールされているかのような振る舞いを見せる。
夜行性だったアワヨトウは、あたかもコマユバチの脱出に備えるかのように昼間、植物の葉に留まるようになります。コマユバチは、アワヨトウの体表を破って脱出して、葉の上で繭を作りますが、コマユバチの脱出が終わるとアワヨトウは最後の力を振り絞って葉から移動し、別の場所で絶命するのです。これは死骸が腐敗して繭を汚染しないように、コマユバチがアワヨトウを操っているといわれています。
寄主のこうした驚くべき行動の機序はまだわかっていませんが、アワヨトウへのコマユバチの寄生には、ポリドナウイルスというウイルスが、大いに役立っています。ポリドナウイルスは、寄生バチのメスの卵巣に存在し、産卵の際に寄主に注入されて、寄主の免疫機構を強く抑制する作用があります。昆虫には自然免疫機構があり、本来は他のコマユバチが寄生しようとしても免疫によって排除するはずですが、ポリドナウイルスは、寄主の免疫細胞のアポトーシス(細胞の能動的な死)を促したり、免疫機構において重要な役割を果たすタンパク質の活性を阻害するなどして、寄主の免疫を機能させないのです。さらに寄主昆虫のホルモン分泌も抑制することで、寄生バチに有利な状態を保つという働きも持っています。ポリドナウイルスが、ウイルスとしてさらに興味深いのは、このウイルスの粒子内にはキャプシドを作る遺伝子やさらには複製のための遺伝子すらないということです。
ではどうやってウイルスとしての体裁を保ち、複製しているのでしょうか。実は、それらに必要なタンパク質は、寄生バチから提供されていることがわかってきました。ポリドナウイルスが複製のために必要とする遺伝子は、寄生バチのゲノムの中にあり、それによって複製酵素などが提供されているのです。寄生バチが、ゲノムの中にウイルスを飼っていて、それを使ってアワヨトウに感染しているという何とも不思議な話です。
この例だけでなく、さまざまなゲノムが解読された結果、多くの生物でウイルス由来の核酸が核内の染色体DNAに広範囲に挿入されていることがわかってきました。代表的なものが内在性レトロウイルス(ERV:endogenous retrovirus)です。
このERVによってヒトが重要な機能を獲得している例が、最近、次々に判明しています。その代表例が、ヒトの胎盤形成に重要な合胞体性栄養膜です(図4)。これにはERVのenv遺伝子に由来するシンシチンというタンパク質が利用されています。ヒトをはじめ動物の免疫機構によって非自己である異物は排除されますが、「異物そのもの」といえるような胎児をおなかに宿しておくことができるのは、この合胞体性栄養膜があるからです。この膜は胎盤から胎児に送る血液中の栄養や酸素は通過させますが、「異物」を攻撃するリンパ球などの免疫細胞は通過させず、胎児を守る働きをしています。
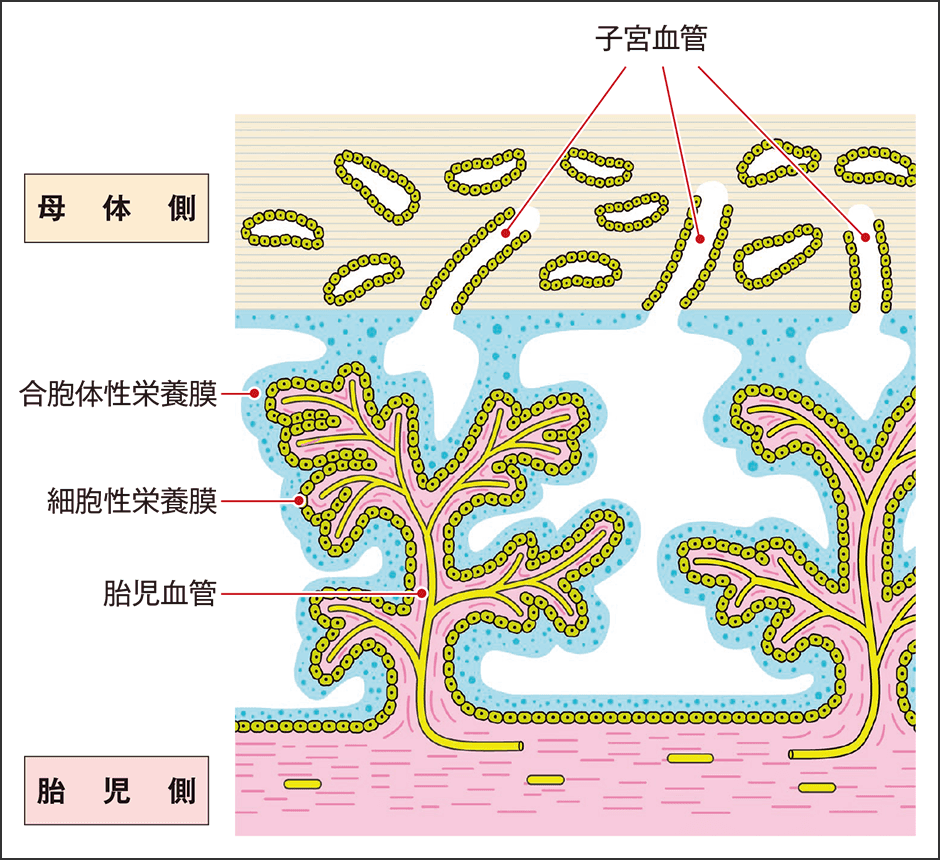
図4 合胞体性栄養膜ウイルスの力を借りて細胞膜を融合させて胎児を守る仕組みができた。
通常、白血球などの免疫細胞は、敵を攻撃するために細胞の間をすり抜けて血管に侵入することができます。ところが胎盤の合胞体性栄養膜は、膜というより細胞同士を融合させたような構造となっており、細胞間に隙間がないため、免疫細胞が通り抜けられないのです。この構造を作るシンシチンは、ウイルスの中では自身のエンベロープを感染相手の細胞膜と融合させて感染を促進させる機能を持っています。つまりヒトの胎盤が持つ高度な仕組みは、元々ウイルスが感染のために持っていた、細胞膜融合を担う遺伝子がヒトゲノムに取り込まれたことで成立したのです。
高度な機能にまで関わっている
ウイルス由来のヒト遺伝子としては、皮膚に保湿性を付与しているサスペースも有名です。進化の過程で陸に上がってきた生物は、皮膚の水分を維持する必要があります。皮膚の保湿層を作る過程でタンパク質を分解する必要があり、その酵素としてERV由来のサスペースが使われています。興味深いのは、サスペースはウロコのない肌を持っている哺乳類にしかないことで、ウイルスに由来する遺伝子が生物の進化に関わることを示唆している一つの例です。
また、2006年ごろに発見されたアークは神経細胞間でのRNAの伝達を助ける役割を果たすタンパク質です。もともとアークはRNAを包み込むウイルス粒子の形成に関与するタンパク質で、その本来の機能を生かして、細胞間のRNA伝達に役立っていると考えられます。このような高度な機能にまでウイルスが関わっているというのです。
ヒトゲノムが解析された結果、LTRレトロトランスポゾンや他の転移因子などがゲノム全体の45%ほどを占めることがわかりました。ヒトゲノムのあちこちに「ウイルスのかけら」が散らばっていることが解明されたものの、それらは当初、機能のない「ジャンクDNA」とされていました。しかし近年の研究で、そういったウイルスのかけらが遺伝子の制御配列としての重要な役割を担っていることが見えてきました。
例えば、iPS細胞を作成するには、有名な山中ファクターと呼ばれる4つの転写因子を導入しますが、このとき4つの因子は4つの遺伝子を動かしているわけではなく、それぞれの転写因子が多数の遺伝子を制御しています。山中ファクターの一つ、Oct-4という転写因子は、ヒトゲノム中のERVの一種であるERV1由来の配列に結合します。ERV1はゲノム中に反復してたくさん存在していますから、例えばOct-4が100個の遺伝子を制御する必要があった場合、それらの近傍にERV1があれば、場所も種類も違う100個の遺伝子を同時に制御することができるようになります。
ヒトの生体内でも大量の遺伝子を動かす必要があるとき、ゲノムのあちこちに散らばっているERVを結合配列とすれば、それに結合する因子はメインスイッチのように働くことができるようになる可能性があります。つまりそのオンオフで、例えば100個の遺伝子にパッと光がつく、すなわち遺伝子が発現する。あるときは逆に光が消えて抑制するというような、下流の遺伝子をまとめて制御する仕組みが簡単にできあがります。ゲノムにおけるERVの反復配列はそういった仕組みを提供することに意義があるのではないかという見方も出てきています。
シンシチン、サスペースやアークといった物質が「ヒト」を誕生させる重要な役割を果たしていることがわかってきたことに始まり、現在、ウイルスの配列がゲノムに散在していることによって、ヒトの遺伝子が構造化、ネットワーク化されているということまで見え始めています。ウイルスは感染症をもたらす脅威でもある一方、私たちの進化に欠かせないパーツでもあるのです。