ゲノム編集は、塩基配列を切ったり他の配列をつなげたりしてDNAを改変する技術で、遺伝子組み換えもその一つ。現在はより進化した方法が登場し、食品をはじめとして医療、エネルギーなど、さまざまな分野で実用化が進んでいる。一方、遺伝子の改変は生命に直接影響するだけに、安全性や生命倫理について、社会を広く巻き込んでの慎重な議論が何より重要なのだという。
特集 ゲノム編集入門 〈巻頭インタビュー〉
より安全で効率的な改変に! 進化する「編集技術」
構成/飯塚りえ
「ゲノム」とは、ある生物が持つDNAに含まれる、すべての遺伝情報のセットを指します。生物の特徴を決めるのが遺伝情報ですから、「ゲノムを編集する」のは、遺伝子を改変してその生物の特徴を変えることになります。2012年にCRISPR-Cas9(クリスパー・キャス・ナイン)と呼ばれるゲノム編集技術が開発され、その後さまざまな分野に普及することとなりました。
始めに、遺伝子を改変するとは、具体的にどのようなことをするのか見てみましょう。
遺伝子は、アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)という塩基がつながってできた生命の設計図です。遺伝子の改変は、この長い遺伝子の設計図を途中で切断することから始まります。そしてDNA自身が持つ修復機構を利用して、切れた遺伝子を改めてつなげたり、他の配列を導入したりするのです。こうした遺伝子の改変技術は1973年、現在いわれているゲノム編集の登場(2005年)より30年以上も前に、制限酵素を用いてDNAの二本鎖を切断し、細菌の中で修復するという方法が確立されています。
望んだ配列だけを切断することに成功
ではゲノム編集技術は、従来の改変技術と何が違うのでしょうか。
ゲノム編集において特筆すべきは効率と特異性です。まず改変の最初のステップである、狙った部分のDNAを切断することが高い精度で行えるのです。
「DNAを切断する」とは、つまり塩基の結合を解く化学反応を起こすことで、初期の組み換え技術の時代から、生物が持っている酵素(ヌクレアーゼ)が使われました。ヌクレアーゼには、制限酵素といってDNAだけを切断するもの、RNAだけ、あるいは決まった配列だけを切断するものなど、いくつかの種類があります。1990年代後半、「ZFN(ジンク・フィンガー・ヌクレアーゼ)」として人工的に酵素をつくって、望んだ配列だけを切断することに成功しました。この手法は現在でも医療の現場で広く使われています。
次に出てきたのが、植物の病原細菌から開発された「TALEN(ターレン)」という手法で、1個の塩基を認識することから重宝されました。
そして2012年に開発され、簡単に使え効率も良いため、現在広く普及しているのが、CRISPR-Cas9です。
CRISPR-Cas(Clustered Regularly Interspaced Short Palindromic Repeat/CRISPR associated protein)という用語は、一般にはゲノム編集ツールを想起されるかもしれませんが、微生物の研究者にとっては細菌や古細菌が持っている免疫システムとして認識されています(図1)。
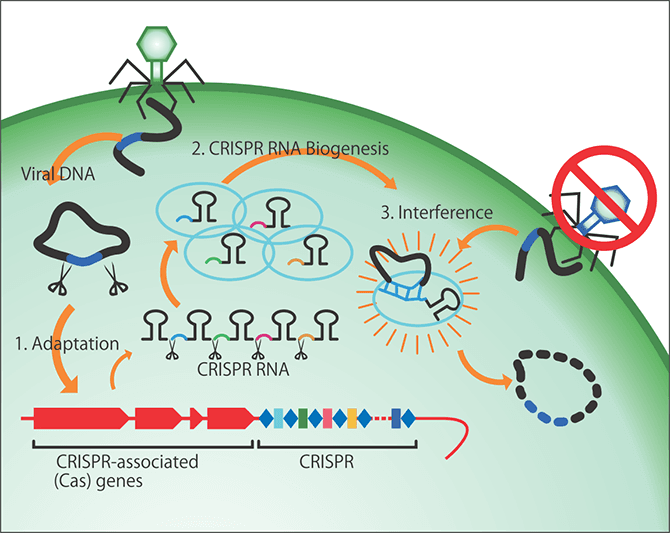
図1 CRISPR-Cas細菌・古細菌が持つ獲得免疫として発見され、その後ゲノム編集のツールとして開発された。古細菌は、感染ファージ等の外来DNA断片を取り込み、相同RNAを合成することで、外来DNAを切断する。水色の楕円部分はファージを取り込み、標的DNA配列に導くgRNA(ガイドRNA)とCas9が協働して、狙った遺伝子を切断する。
細菌が持つCRISPR-Casシステムは、あたかもヒトの獲得免疫のように振る舞います。微生物に感染するウイルスをファージといい、ファージに感染すると、細菌はそれを自分の中に取り込んで記憶し、次の感染ではそのファージを特異的に破壊するのです。細菌のこの仕組みが発見されたときは衝撃をもって受け止められましたが、そのCRISPR-Casシステムを利用して、アメリカの研究者が開発したのがゲノム編集技術なのです。
これらゲノム編集ツールは、ヒトの場合、30億にもなるDNAのうち、狙った所を切断することのできる秀逸なシステムです。ゲノム編集が画期的とされるのは、この点にあるのですが、これまで難しかった「狙った所を切断する」ことが、どうしてできるのでしょうか。
たった1個の塩基の書き換えも可能
ヒトを例にしましょう。A、T、G、Cの塩基の配列パターンを考えたとき、4文字が同じ配列で並ぶ確率は4×4×4×4で256文字に1回です。つまり4文字単位で考えると、256文字に1回は同じ配列が並ぶことになります。ゲノム編集以前の制限酵素は、概ね4~8個の文字を認識するので、4文字では256文字あれば同じ配列が1回、8文字でも65536文字で1回は出現する可能性があるということになります。ヒトのDNAは30億ですから、目的のDNAを切断するには回数を重ねて“運”を待つ必要がありました。
しかし、CRISPR-Cas9は20の文字列を認識します。計算上は4の16乗で40億を超えますから、4の20乗の文字パターンは30億の中に1個です。つまり30億のDNAの中に同じ配列を持っているのは、高い確率で「そこしかない」ため、狙った1個のDNA、さらにたった1個の塩基をも書き換えることができるのです(図2)。
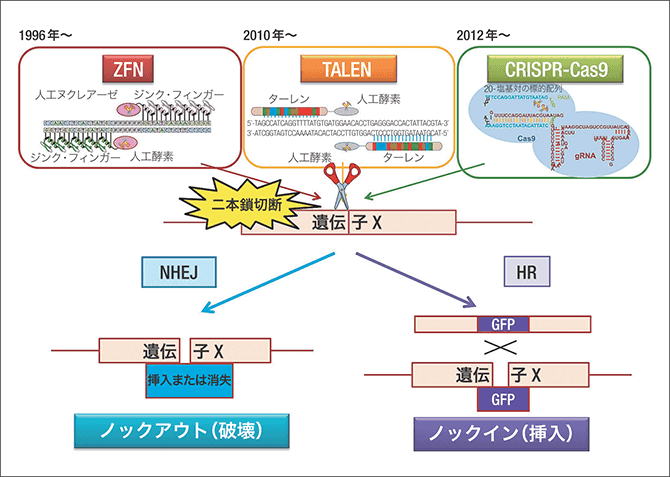
図2 ZFN/TALEN/CRISPR-Cas9によるゲノム編集人工の酵素が狙った所にある遺伝子を切断する。ターゲットとしたい20文字に結合するようなgRNAを作成できるため、特異的に配列を認識し、CRISPR-Cas9で切断することができる。切りたいものだけを切る、切りたくないものは切らない“はさみ”がつくれるようになった。そのままDNAが結合されたり(消失)、別の遺伝子が取り込まれる(挿入)などがある。さらに相同組み換え(HR)を利用して、例えばGFP(光るタンパク質)の遺伝子を切断した部分に挿入し、その後、遺伝子をトレースするなども可能。
DNAの修復には二つの方法があります。一つは、「非相同末端結合(NHEJ:Non-Homologous End Joining)」といい、簡単にいえば切れたDNAの端同士を結合するものです。このとき、切れた直後では元どおりの配列になることもあるのですが、細胞の性質上、一部を削ってしまい、それまであった配列が抜けることがあります。ゲノム編集では、これを遺伝子のノックアウトといい、ある働きをしていた遺伝子が消失することを意味します。
もう一つの修復は、「相同組み換え(HR:Homologous Recombination)」といわれるものです。
ヒトは両親由来の染色体を一対持っています。ということは、細胞の中でDNAが切断されても、もう片方の染色体の似たような配列を鋳型として修復することができます。これが相同組み換えという方法です。ゲノム編集においては、切り離したDNA部分に、希望の配列を挿入して、組み換えを起こします。これをノックインといいます。
外来の遺伝子を導入しない
ゲノム編集は遺伝子組み換えと何が違うのかと質問されることがよくありますが、言ってみればゲノム編集は今までの組み換えの上位概念です。
例を挙げましょう。ゲノム編集によって誕生した通常に比べて肉量が多いフグは、1万個ほどの遺伝子のうち、筋肉の組成に関わるミオスタチンという、たった1個の遺伝子を破壊しただけで、外来の遺伝子を導入したわけではありません。このようなフグはゲノム編集の技術を借りなくとも、自然界で十分に起こり得る変異なのです。ゲノム編集によってその出現の確率を高くしただけなのです。
またこれまで「品種改良」と呼ばれていたものは、時に遺伝子を壊すために放射線を当てたり特殊な薬剤を与えたりすることがありました。その際、ターゲットとは異なる他の遺伝子が破壊され、意図しない変異が起きたり、細胞そのものが死んでしまうことも起こります。そのような意味では、ゲノム編集のように狙った部分だけを改変できる技術のほうが、精度が高いといえます。
他方、遺伝子組み換えでは、切断したDNA部分にその生物が本来持っていなかった遺伝子を導入することがあります。これは自然界では起こり得ない変異です。ゲノム編集においてもそのような改変は可能ですが、ゲノム編集がすべて外来の遺伝子を導入するものでないことは理解する必要があります。
同時に、日本ではゲノム編集による生産物に、届け出と承認の義務を課していますし、実験に使用する場合でも使用許可を取るなど厳しく制限されています。
また日本は、遺伝子組み換えなどの生物の扱いを決めた国際条約「カルタヘナ議定書」に批准して、遺伝子の改変が行われた生物が拡散して他の生物に取り込まれることなどがないよう、厳格に管理されています。
現在ゲノム編集を行ったという表示について、厚生労働省では、外来の遺伝子を導入したものについては届け出ることとしていますが、遺伝子を破壊したものについては、交配を繰り返す従来の育種と区別するのが難しいとして表示の義務を課していません。実際に表示されるかどうかは、今後、消費者の捉え方なども考慮しながら進んでいくでしょう。
この他、ゲノム編集を利用した治療も注目されています。
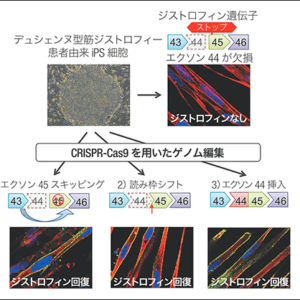
ゲノム編集治療を大きく2つに分けると、細胞を体外に取り出してゲノム編集して体内に戻す生体外治療と、CRISPR-Casを体内に導入して変異を起こさせる生体内治療があります(図3)。前者は血液細胞や免疫細胞の疾患、iPS細胞を使った遺伝子由来の疾病治療などでも知られていますが、ゲノム編集した細胞の安全性を確認したうえで適用できるので、より安全な方法として現在、実用化に向かっています。2017年、世界で初めてゲノム編集とCAR-T細胞療法を利用して白血病の赤ちゃんを治療したという報道もありました。しかし生体外だけでは治療できない疾病もあり、世界では生体内でのゲノム編集の臨床試験が始まっています。

図3 ゲノム編集を利用した治療ゲノム編集治療は、生体外で行う場合と、生体内で行う場合とを分けて考える必要がある。前者は、実用化に向けて着実に進んでいる。後者は、治療の後戻りはできないことから、一層の安全性を確立しなくてはならない。
このようにゲノム編集は革新的で有用なツールです。一方で私たち研究者には、この技術がどのように使われているのかを分かりやすく説明していくことが求められます。また、より安全性の高い技術を開発していかなくてはなりません。遺伝子を改変することの安全性や倫理については、広く社会を巻き込んで慎重に議論を重ねていくことが、特に重要なのだと思います。
日本でCOVID-19迅速診断キットを開発
実はゲノム編集を利用した科学研究について、日本は残念ながら世界に後れを取っている状況です。理由の一つには、重要なゲノム編集ツールの一つであるCRISPR-Cas9はアメリカで開発され、莫大なロイヤリティが必要なため簡単に利用できないという背景があります。当然、現在のCRISPR-Cas9が完璧なツールというわけでもなく、各国ともさらに安全で自由に使える“自前”のツールの開発に躍起になっています。
私たちのチームではCRISPR-Cas3という新しいツールを開発し、日本の企業が利用できるようにしています。CRISPR-Cas9は、レンサ球菌の免疫機構を利用していますが、同様の免疫機構を持つ細菌は、他にいくつかあります。CRISPR-Cas3も、違う細菌の機構を利用し、かつ27文字を認識できるので、CRISPR-Cas9よりもさらに安全性が高いと考えています。
CRISPR-Cas3などはゲノム編集における“はさみ”の役割を担いますが、私たちは、この機能を利用して、新型コロナウイルス感染症(COVID-19)迅速診断キット「CONAN(Cas3 Operated Nucleic Acid detectioN)法」を開発しました(図4)。
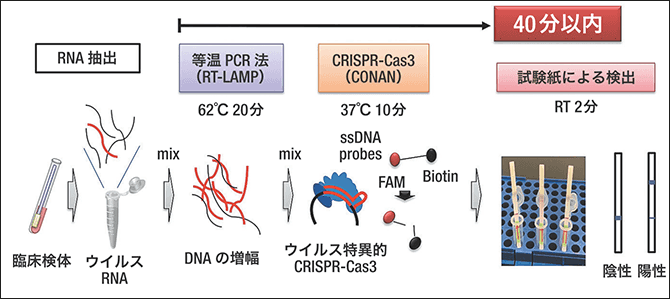
図4 CONAN法による新型コロナウイルス検出法の概要患者のサンプルを採取したのち、最短40分以内に検出できる。一般的な試薬、試験紙、保温装置だけでできるので、簡易で迅速かつ低コスト。CRISPR-Cas3は1塩基の違いをも検出できるため、薬剤耐性や重症化に導く変異がウイルスに生じた際にも即座に検出法を確立することができる。
現在、COVID-19の検査には、抗原、PCR、抗体があります。抗体検査では感染後のIgGやIgMといった抗体の値を診ており、分かるのは、その人が罹患したことがあるかどうかだけで、現在の感染を示すものではありません。今の状況を知って、感染の拡大を防ぐにはPCR検査か抗原検査ですが、PCR検査は感度が最も高いものの、時間も費用もかかります。他方、抗原検査は、ウイルスの表面タンパク質そのものを見つける検査方法で、簡単ですが、ウイルスのタンパク質量が少ないと検知されない、また類似するウイルスを検知してしまうというデメリットがありました。そこで私たちは、CRISPR-Cas3を用いて抗原検知のCONAN法を開発し、この2つのデメリットを克服したのです。
CONAN法は、COVID-19のウイルスを認識し、同時に近傍のマーカーを切断して光らせるという方法で、最短40分以内に正確にウイルスを検出することに成功しています。こうしたCRISPR-Casの利用例のように、ゲノム編集は、基礎研究から応用まで、また医療、農産物、エネルギーなど、多くの分野で利用されており、なくてはならないツールとなっているのです。