体内で作られるペプチドはさまざまな生理活性を持つことが知られているが、産生過程で発生する99.9%以上もの「端切れ」の断片ペプチドは生理的に機能しないとされてきた。しかし近年、自然免疫系の中心的役割を担う好中球を活性させる断片ペプチド「クリプタイド」が発見された。その後も、細胞増殖や創傷治癒など、さまざまな機能を備えたクリプタイドが報告されているという。画期的な治療薬の可能性が期待される。
特集 ペプチドの世界 体内で作られる「端切れ」 断片ペプチドに生理活性
構成/大内ゆみ
私たちの身体の中で生合成されるタンパク質は、DNAの遺伝情報をもとに作られた前駆体(生成される前の段階にある物質)が、プロセッシングプロテアーゼという酵素(プロテアーゼ)によって切断されることで成熟体となりタンパク質として機能します(図1)。この切断の過程で作られるのがペプチドで、外から食品として摂取するペプチド(外因性ペプチド)と区別して内因性ペプチドとも呼ばれています。
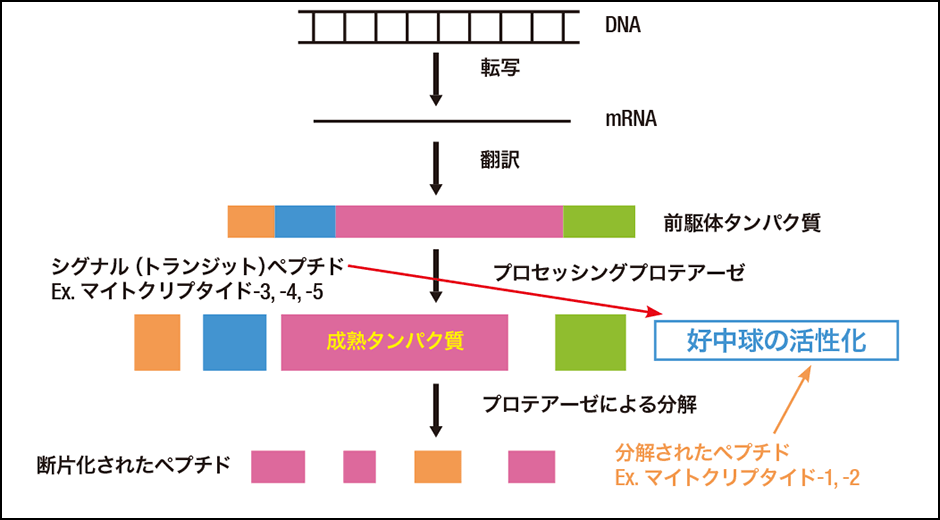
図1 生理活性ペプチドや機能タンパク質の生合成機構タンパク質は、前駆体がプロテアーゼによって切断されることで機能を持つ成熟体になり、さらにプロテアーゼの分解により不活化する。この過程で、多数の断片ペプチドが生じる。
生理的に機能しないという考えが通説
体内で作られるペプチドは、生体の細胞・組織間での情報のやりとりを担う中心的存在として、血糖や血圧の調節、神経の伝達や調節など、多様な生理活性作用を持つことが知られています。こうした生理活性ペプチドは2~60個程度のアミノ酸から構成され、タンパク質のように立体構造を形成せず、血液や体液中を百面相のごとくいろいろと形を変えながら、細胞膜の受容体に結合することにより機能を発現しています。
このようにペプチドはプロテアーゼによって切断・断片化することによりタンパク質から産生されますが、それらペプチドの99.9%以上は、いわば服を作るときにできる端切れのようなもので、機能はなく、単にタンパク質を再合成するためにアミノ酸として再利用されるだけだと考えられていました。詳しく言うなら、過去の研究で断片ペプチドの生理的機能が発見されても活性が弱いことから、生理的に機能しないという考えが通説でした。しかし近年、断片ペプチドの中に重要な機能を持つものがあることが明らかになったのです。その世界初の発見となったのが、私たちの研究によって同定された好中球を活性化する機能を持つペプチド、マイトクリプタイド(MCTs)です。
好中球は白血球の一つで、通常は血液中に存在していますが、微生物の侵入や組織傷害が起こると迅速にその部位に浸潤し、殺菌、有毒物質の貪食、炎症性サイトカイン(炎症反応を促進する働きを持つ低分子タンパク質)の分泌などの役割を果たすことにより、自然免疫系において中心的役割を担っています。しかし、好中球が過剰に浸潤すると、逆に生体にダメージを与えることもあります。例えば、心筋梗塞に伴う虚血後、血流が再開すると、大量の好中球が心臓に集まり、ダメージを受けた心筋細胞を除去することによって、心臓が収縮できなくなる、つまり心臓のポンプ機能が低下することが知られています。また、感染症や組織傷害などでは、本来は生体の防御反応である炎症が長引き、致命的な臓器不全に至ることもあります。
発見に至るきっかけは約30年前、留学先の腎臓内科の医師からの疑問でした。腎臓に障害が起きると大量の好中球が集まるが、好中球を誘導すると考えられているインターロイキン8(炎症性サイトカインの一種)は見つからないため、最初に好中球を誘導している物質が他に存在するのではないかと言われたのです。
ミトコンドリアに存在する断片ペプチド
インターロイキン8のような炎症性サイトカインは、炎症刺激が起きた後にDNAから転写・翻訳され、プロテアーゼによる分解を経て作られるため、作用するまでには数時間を要すると考えられます。このため、炎症の極めて初期の段階では、他の好中球遊走因子が機能していると考えられます。実際に、好中球遊走因子としてミトコンドリア(細胞内にあるエネルギーを産生する小器官)のタンパク質の関与が指摘されていましたが、同定には至っていませんでした。そこで、好中球遊走因子は、健康な組織内にあらかじめ存在していて、炎症が起きたときに速やかに機能できる生理活性ペプチドの一種ではないかと推測し、研究を始めました。
最初に試みたのは、好中球活性化ペプチドの同定です。私が当時所属していた筑波大学のある茨城県は養豚が盛んな地域で、食肉加工業者の皆さんの協力を得て、健康なブタから新鮮な心臓を入手し、スライスしたものを直ちに100℃の沸騰水中で熱処理しました。ペプチドはプロテアーゼにより分解され、機能を失ってしまうために、まずは熱処理によってプロテアーゼを失活させる必要があったのです。それから、ペプチドの抽出と精製を行い、2つのペプチドの生成に成功しました。化学構造を解析したところ、それらはともにミトコンドリアに存在するタンパク質の断片ペプチドであることがわかったのです。
化学構造がわかれば化学合成が可能になります。化学合成をした両者の機能を調べてみると、ナノモラー(nM)レベルという低濃度で、ヒトの末梢血液から精製した好中球を活性化するとともに、異物や毒素などを貪食し分解させる作用を持つことが明らかになりました。そこで、これらの新しい好中球活性化ペプチドを、ミトコンドリアタンパク質由来であることから、マイトクリプタイド-1(MCT-1)、マイトクリプタイド-2(MCT-2)と命名しました。
さらに研究結果からMCT-1やMCT-2の他にも活性を持つ断片ペプチドの存在が推測され、解析を進めていった結果、それらのペプチドのほとんどがミトコンドリアタンパク質由来であることが明らかとなり、好中球の機能がこれら多数のミトコンドリアタンパク質に由来するペプチドにより調節され生体を防御している可能性が考えられるようになりました(図2)。そこで私たちは、このようなタンパク質に隠された、もとのタンパク質と全く異なる機能を持つ活性ペプチドを総称して「クリプタイド」と命名しました。
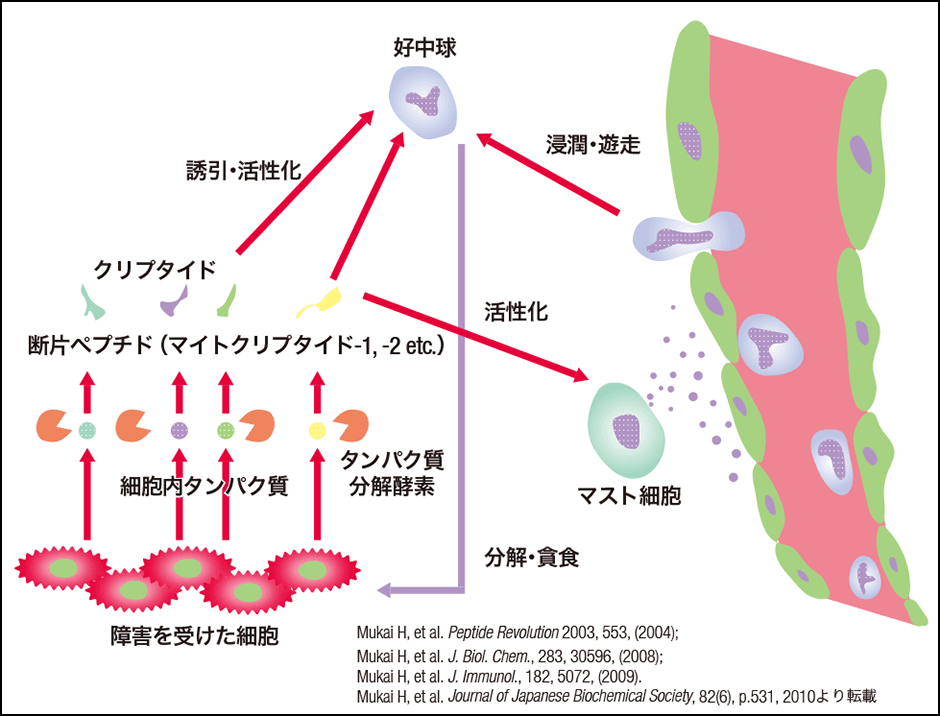
図2 好中球活性化クリプタイドによる新しい生体防御機構多数のミトコンドリアタンパク質由来ペプチド、マイトクリプタイドにより好中球の機能が調節されているという新しい生体防御機構が示唆された。
このように多数のミトコンドリアタンパク質由来のペプチドが、自然免疫応答を調節していることが考えられるようになったので、私たちはタンパク質データベース(Swiss-Prot)から、いまだ同定されていない、生体に存在する好中球活性化クリプタイドの探索を行いました。そして50種類以上のMCTsを同定しました。これらのMCTsは、それぞれ構造上の特徴があり、好中球を活性化するための細胞内の情報伝達の仕組みにはいくつかの系統があることが、これまでの研究により明らかになっています。例えばMCTsには、ミトコンドリアの移行配列を持つものがあります。移行配列とはミトコンドリアのタンパク質の前駆体が持つ配列で、この配列が認識されてミトコンドリアに輸送されます。輸送後、プロテアーゼにより切断され、ミトコンドリアの主要な機能であるエネルギーを作り出すタンパク質となり、同時に切断され作られた移行配列由来のペプチドは、高い好中球の活性化能を持つMCTsとしてミトコンドリア内のマトリックス(内膜で囲まれた部分)に蓄積されることが考えられました。そして、細胞がダメージを受けると、マトリックスのMCTsが外に放出され、好中球を活性化するのではないかと推測しました。このようにMCTsは、ケモカインとは異なりタンパク質が新たに合成される必要がないため、好中球をはじめとした免疫細胞に対して迅速な情報伝達が可能で、異物などをいち早く処理するハウスキーピングのような役割を果たしていると考えられます。
- * ケモカイン:インターロイキン8などの白血球の遊走を誘導するサイトカイン。
加えて、こうしたミトコンドリア移行配列由来のMCTsは、好中球のGタンパク質(細胞内情報伝達に関与するタンパク質)を直接活性化することが明らかとなってきました。また、これらのMCTsは、単独種では活性を示さない閾値以下の濃度でも、複数種を混合することにより協奏的に作用し、好中球様細胞を効率的に活性化することも見出しています。
これらMCTsのうちMCT-2は、好中球の表面にあるホルミルペプチド受容体2(FPR2)を特異的に活性化します。しかし、MCT-2はプロテアーゼにより切断されることで、今度はホルミルペプチド受容体1(FPR1)を活性化するようにシフトを起こすこともわかりました。好中球の遊走因子の受容体であるFPR1は、最近、炎症の抑制や創傷治癒・組織再生に関わることが報告されていることから、ウイルスなどの異物が細胞にダメージを与えると、まずはFPR2による異物への攻撃のスイッチが入り、MCT-2が切断されることによって、FPR1による回復のスイッチが入るものと推測しています(図3)。また、このスイッチが加齢など何らかの原因でうまく切り替えられなくなると組織傷害をもたらし、新型コロナウイルス感染症など、感染症の重篤化による多臓器不全を引き起こす原因となるのではないかと考えています。加えてMCT-2と同じような活性を持つMCTsも発見されており、これらが協働して免疫反応を起こしていると推測しています。
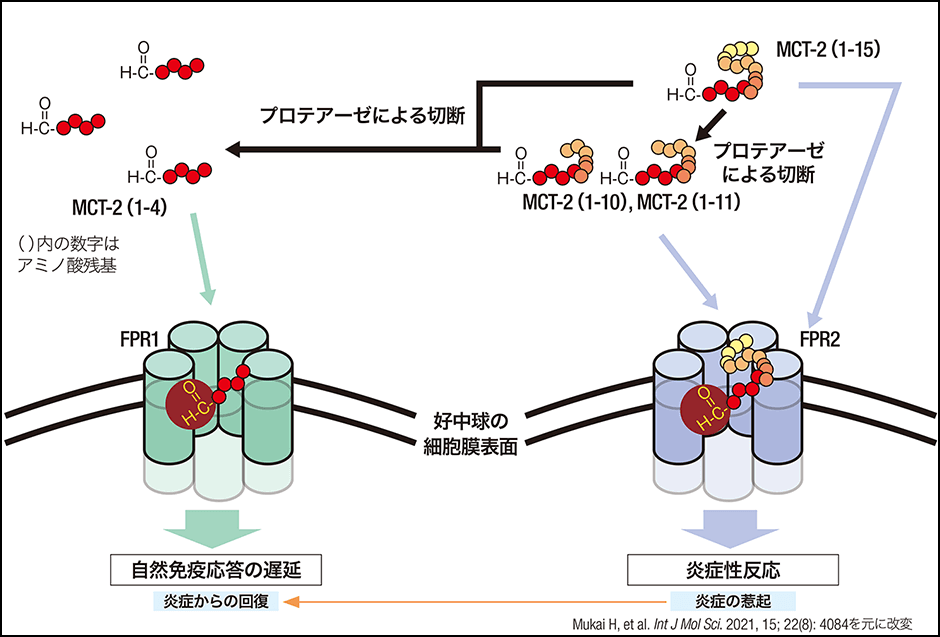
図3 MCT-2の自然免疫応答のメカニズム損傷した細胞から放出されたMCT-2は、最初にFPR2を活性化する。時間の経過とともにプロテアーゼにより切断されたMCT-2は、FPR1を活性化し、炎症性反応から回復に関与する可能性がある。
非感染性の自然免疫に関わる因子の存在
さらに最近では、細胞がダメージを受けると、ミトコンドリアが細胞外、あるいは血中に放出されるというエビデンスが蓄積され、非感染性の自然免疫に関わる因子としてミトコンドリア由来ダメージ関連分子パターン(mitochondrial DAMPs)が盛んに研究されています。このmitochondrial DAMPs中にMCT-2が存在していることも私たちの研究によって明らかになっています。
現在私たちは、個体レベルでの機能をみるために、MCTsに対する中和抗体(特定のタンパク質の活性を阻害できる抗体)、またはMCTsが結合する受容体を阻害する物質(アンタゴニスト)を開発し、マウスを用いた動物実験による研究も進めています。MCT-1の中和抗体の研究では、鎮痛薬であるアセトアミノフェンの大量投与により肝傷害を起こさせたマウスに抗体を投与すると、好中球の浸潤が抑制されることが示されました。しかし、MCT-1の中和抗体の投与は、好中球の浸潤を抑制するものの、投与しないマウスと比べて寿命は変わらないことがわかりました。
これに対しMCT-2の中和抗体の研究では、リポポリサッカライド(LPS)を投与したマウスに中和抗体を投与しました。LPSは、微生物感染時に微生物が出すエンドトキシンという毒素であり、エンドトキシンによる過剰な免疫反応は、致命的な多臓器不全を起こすことが知られています(エンドトキシンショック)。実際に多くの高齢の肺炎患者が亡くなっていますが、今のところ、治療法はありません。
中和抗体を投与したマウスでは、損傷組織に大量に浸潤していた好中球が減少するとともに、症状の改善がみられました。私たちはこれらの事実から、前述したようにMCT-2が切断されることによって、異物の攻撃から回復のスイッチに切り変わったことが原因ではないかと考え解析を進めています。
このように、初期に起こる激しい炎症反応を完全に止めるのではなく、ある程度抑制しながら継続させることにより、ダメージを受けた細胞を好中球などに処理させて、回復のフェーズを活性化させれば、時間は要するものの、完全に組織を修復することができるのではないかと仮説を立てています。現在はこの仮説を検証すべく、総力を挙げて研究に取り組んでいるところです。
炎症をコントロール
以上のように、各種MCTsが作り出す生体防御機構は複雑です。このような炎症応答における複雑性が、前述したような虚血障害や多臓器不全、ひいてはがんやアルツハイマー病などさまざまな炎症性疾患の治療を困難にしている一因ではないかと私たちは考えています。つまり、MCTsの中和抗体やアンタゴニストを用いて、炎症を総合的にコントロールできれば、こうした難治性の炎症性疾患を根本的に治療することも可能ではないかと期待しています。
MCTsの研究を始めた頃は、断片ペプチドに機能はないという説が根強く、ほとんど注目されませんでした。しかし、クリプタイドが協奏して作用することを見出して以降、他の研究グループからも細胞増殖や創傷治癒など、さまざまな生物活性を持つクリプタイドが報告されるようになりました。
私が研究スタッフに口酸っぱく言っているのは、「別の考え方や手法でものごとを見ることができれば、世界の誰もが見えなかった状景を見ることができる」ということ。詳しい手法については触れませんでしたが、ここで紹介した研究も独自のアプローチを用いています。
今後も独自の考え方や手法で、MCTsをはじめとしたクリプタイドの情報伝達機構の解明や受容体の同定に取り組み、これまでにない画期的な治療薬の開発へとつなげていきたいと考えています。