腎臓はとても精緻な構造を持つため、慢性腎臓病が悪化した末期腎不全を根本的に治療する方法は今のところ存在しない。代替療法としては透析療法や腎移植があるが、透析には大掛かりなシステムが必要で患者の負担も大きい。腎移植のほうが良いとされてはいるものの、ドナー不足の問題がつきまとう。そこで期待されるのが、異種移植とiPS細胞の融合による再生腎臓だ。異種胎仔を利用してヒトiPS細胞から再生される腎臓は、複雑な立体構造の形成を可能にする。
特集 ここまできた! 「腎不全」医療 異種移植とiPS細胞の融合で腎臓の再生が可能になる
文/渡辺由子 イラストレーション/千野六久
東京慈恵会医科大学腎臓・高血圧内科の横尾隆主任教授は、20年以上前から幹細胞を使った腎臓再生の研究に挑んでいる。近年は、他大学や製薬会社などとの共同研究で、異種移植とiPS細胞による再生を融合した「ハイブリッド臓器」で、精巧な立体構造を持った腎臓を再生する「異種再生医療」に取り組み、臨床への応用の最終段階に入りつつある(図1)。
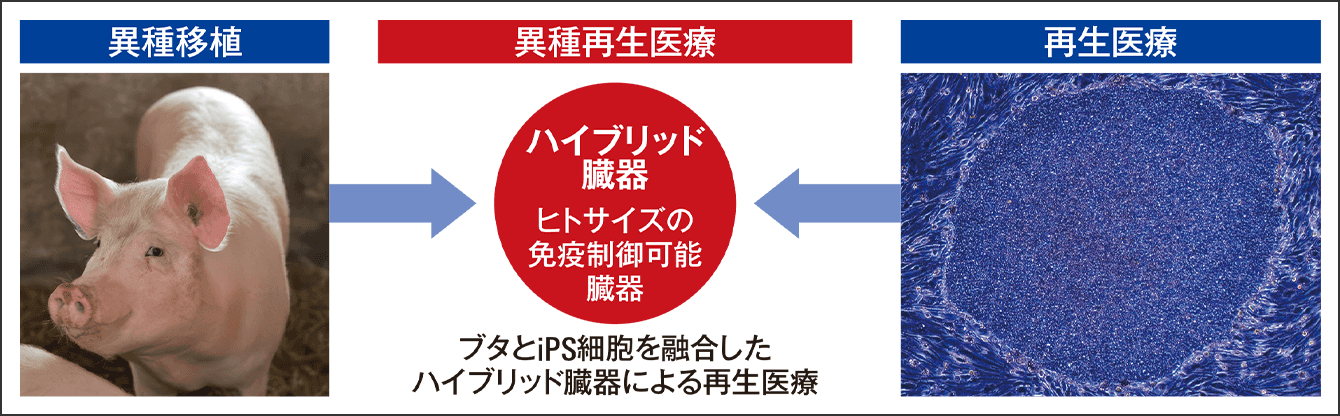
図1 横尾教授の研究グループが取り組む異種再生医療のコンセプト腎不全に苦しむ患者に再生した腎臓をいち早く届けようと、横尾教授らの研究チームは、「異種移植」と「再生医療」の利点を活用した「異種再生医療」に取り組む。研究は最終段階までたどり着いている。
根本的な治療法がない末期腎不全
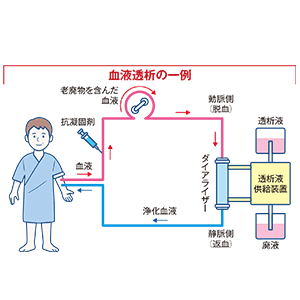
横尾主任教授が腎臓再生に挑戦する背景には、慢性腎臓病が悪化した末期腎不全において、根本的な治療法がないことがある。「腎代替療法」として、透析療法(血液透析・腹膜透析)や腎移植があるが、生命予後の点で透析療法よりも腎移植のほうが良いとされていても、世界的にドナー(臓器提供者)は不足している。
日本では、日本臓器移植ネットワークに登録する献腎移植(脳死下・心停止)希望者数は、2023年4月30日時点で1万3757人(肝腎同時移植・膵腎同時移植含む)。その希望がかなうのは、1年間で2%程度に過ぎない。また、日本臨床腎移植学会と日本移植学会が毎年発表している腎移植実施症例数は、献腎移植や夫婦や親子間などでの生体腎の提供(生体腎移植)を含め、新型コロナウイルスの感染拡大前の2019年に、ようやく2000例を超えたが、慢性的なドナー不足は明らかだ。
「腎移植におけるドナー不足を解消する方法として、注目を浴びているのが『異種移植』です。2021年12月、アメリカで重い心臓病の男性患者に、免疫拒絶が起きないように遺伝子改変したブタの心臓移植が、世界で初めて行われました。男性患者の病態は重篤でしたが、ブタの心臓の移植により、術後約2カ月も生存できたそうです。さらに、アメリカでは脳死患者に遺伝子改変したブタの腎臓を移植する研究も行われ、移植直後から尿が生成されたことが報告されています」
ES細胞やiPS細胞などの多能性幹細胞から臓器を作る再生医療の研究も進み、日本では一部は治療法としても認可されてきている。主なものは細胞療法やシート療法といわれる治療法で、多能性幹細胞を目的の臓器の細胞に分化させ、パーキンソン病の治療として脳に注入する細胞療法や、重症心不全の心筋細胞をシート状にして貼るシート療法などがあり、その成果は現れている。
iPS細胞を用いた腎臓の再生
「一方、ES細胞やiPS細胞から、精巧で三次元的な臓器を丸ごと再生することに端緒を開いたのが、熊本大学発生医学研究所腎臓発生分野の西中村隆一教授らの研究グループです。腎臓は細かく分岐した集合管と、その周囲にろ過をつかさどるネフロンが配置された、非常に複雑な構造であることから、再生が不可能な『神の領域』と呼ばれていますが、2022年1月、マウスのES細胞から腎臓形成に必要な3種類の細胞を組み合わせて、高次構造を持つマウス腎臓を、試験管内で作製することに成功したと発表しました。複雑な臓器の構造をマウスのES細胞のみから作った、世界初の例です。
これら画期的な研究から、次世代の腎不全治療法の候補の一つである異種移植への道は確実に開かれつつあります。しかし現時点では免疫拒絶の課題が残ります。免疫抑制剤による管理が行われても、長期の維持は難しく、実用化にはまだ時間がかかるでしょう。一方、2つ目のiPS細胞やES細胞を使った、臓器丸ごとをつくる再生医療についても、ヒトの腎臓は握りこぶしほどの大きさであり、試験管内の研究を経て、その大きさにするまでには、やはり膨大な時間が必要だと見ています」
横尾主任教授は、自身が取り組む「異種再生医療」の研究コンセプトについて、次のように説明する。
「神の領域と呼ばれる腎臓も、元をたどれば、一つの受精卵に行き着きます。すべての細胞や臓器は受精卵が分化してできていることを考えると、胎児の体の中で腎臓になるプログラムが働いているわけで、そのプログラムを利用すれば、腎臓の再生は100%可能だと考えています。腎臓が発生するプログラムをすべて解き明かし、ES細胞にそのプログラムを与え、一から腎臓をつくり上げようとしているのが先ほどの熊本大学の研究グループです。一方、私たちは一日も早く末期腎不全患者に新たな腎臓を届けることを考え、iPS細胞から『腎臓発生のプログラムと腎臓に育つための場を、動物の胎仔に借りて、腎臓を再生する』、というコンセプトを基にした『胎生臓器補完法』の研究を行っています」
異種の臓器発生環境を利用
ヒトの腎臓は、発生過程で前腎・中腎・後腎が形成される。前腎は発生初期に退化、中腎は一部の機能を残して消失、後腎が成長して腎臓(永久腎)になる。腎臓が発生する際には、受精卵から腎臓へ分化することが運命づけられた「ネフロン前駆細胞」ができる。この細胞は腎臓の構成部位である糸球体から近位尿細管や遠位尿細管まで分化する能力を持った腎臓前駆細胞の一種である。いわば、腎臓の赤ちゃんだ。
さらに受精卵は、ネフロン前駆細胞がうまく腎臓に分化する環境(ニッチ)も胎児の体の中に作る。このニッチは、腎臓の赤ちゃんを育てる保育所のようなもので、ネフロン前駆細胞はこの中で、腎臓の発生プログラムにのっとって後腎となり、成熟した腎臓へと育っていく(図2)。
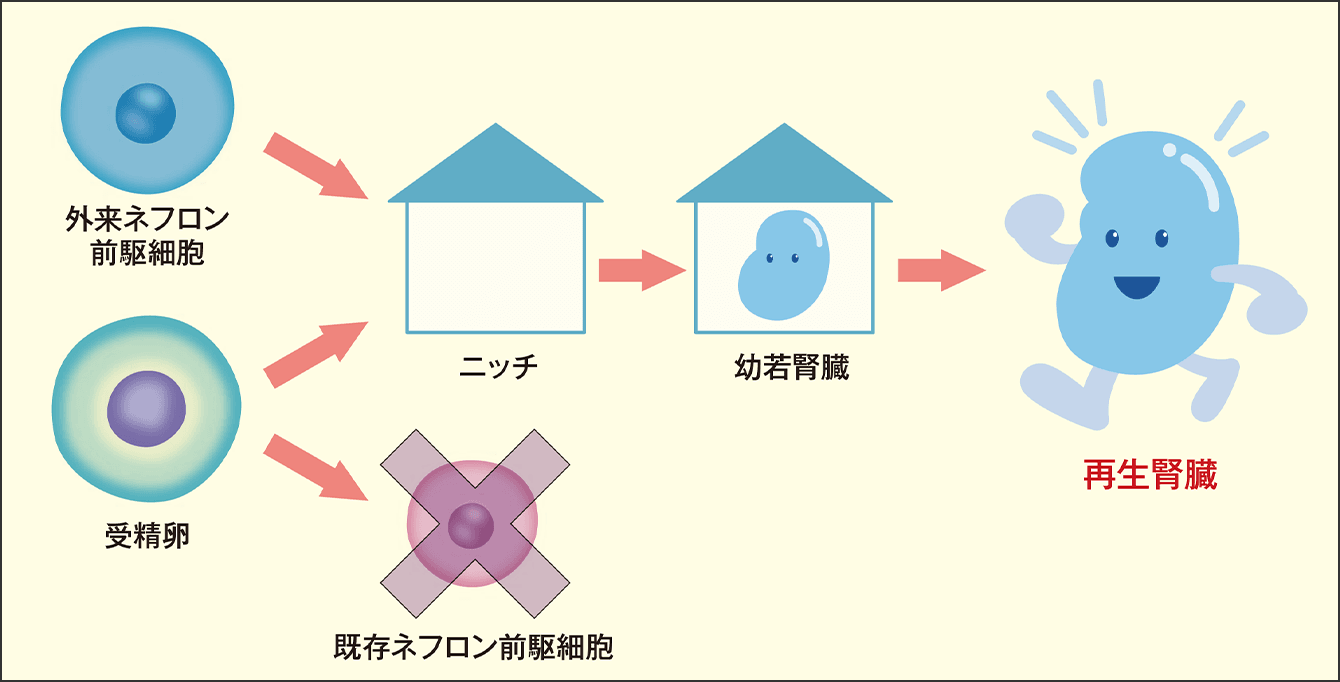
図2 異種胎仔のニッチを使用して腎臓再生「異種再生医療」は、異種の胎仔の臓器が発生する環境(ニッチ)を借りて、ヒト由来のiPS細胞から腎臓の赤ちゃんを育ててもらう。そのためには、異種の腎臓に消えてもらうことが必要だ。
「後腎まで育つと、その後は保育所であるニッチから出ても、自ら分化することによって、成熟した腎臓へと成長していきます。そこでこの現象を利用して、異種のニッチに外来のヒトネフロン前駆細胞を注入して、ヒト腎臓まで分化させることに取り組みました。通常ニッチ内には元の異種のネフロン前駆細胞が存在するため、外来のネフロン前駆細胞を異種のニッチに注入しても、そのままでは双方の細胞からつくられるキメラ(一つの個体の中に複数の遺伝情報を持っている状態)の腎臓ができあがってしまいます(図3)。そこで、薬剤投与により異種のネフロン前駆細胞を都合の良い時期に細胞死させる遺伝子操作を行った異種動物をつくり、そのニッチを借りることで既存のネフロン前駆細胞を除去し、100%外来由来のネフロン前駆細胞由来の腎臓を樹立させるシステムを開発しました(図4)」
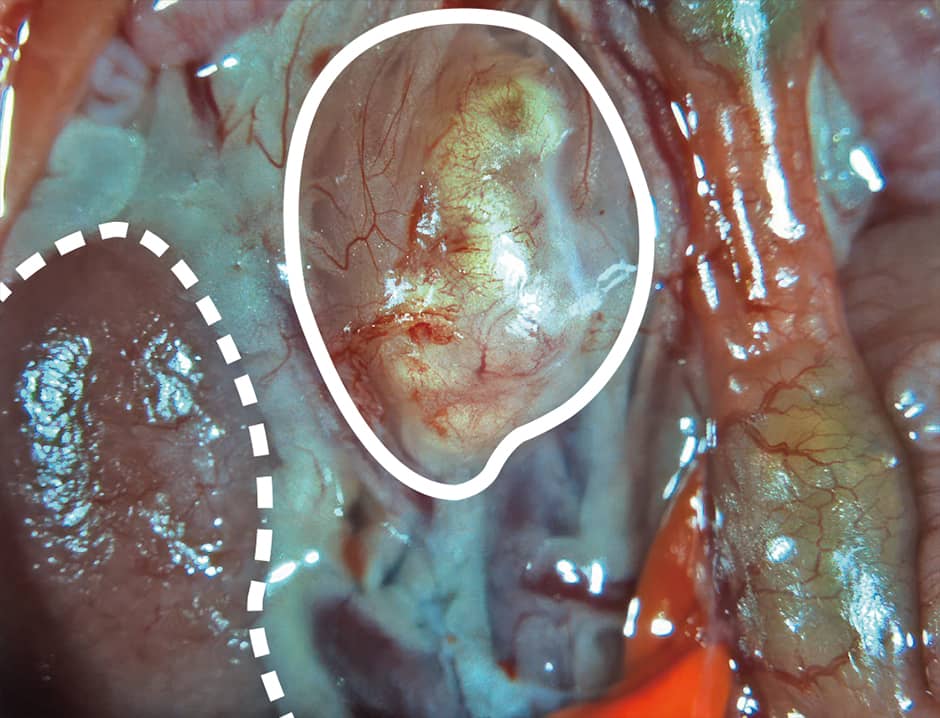
図3 マウスのニッチで生育したマウスの再生腎臓マウスのニッチで、マウスの再生腎臓(実線で囲んだ部分)が機能し、尿も生成されることが確認できた。この時点では、マウス本来の腎臓(点線で囲んだ部分)も生育。図4のシステム開発により、異種胎仔のネフロン前駆細胞除去も可能になった。
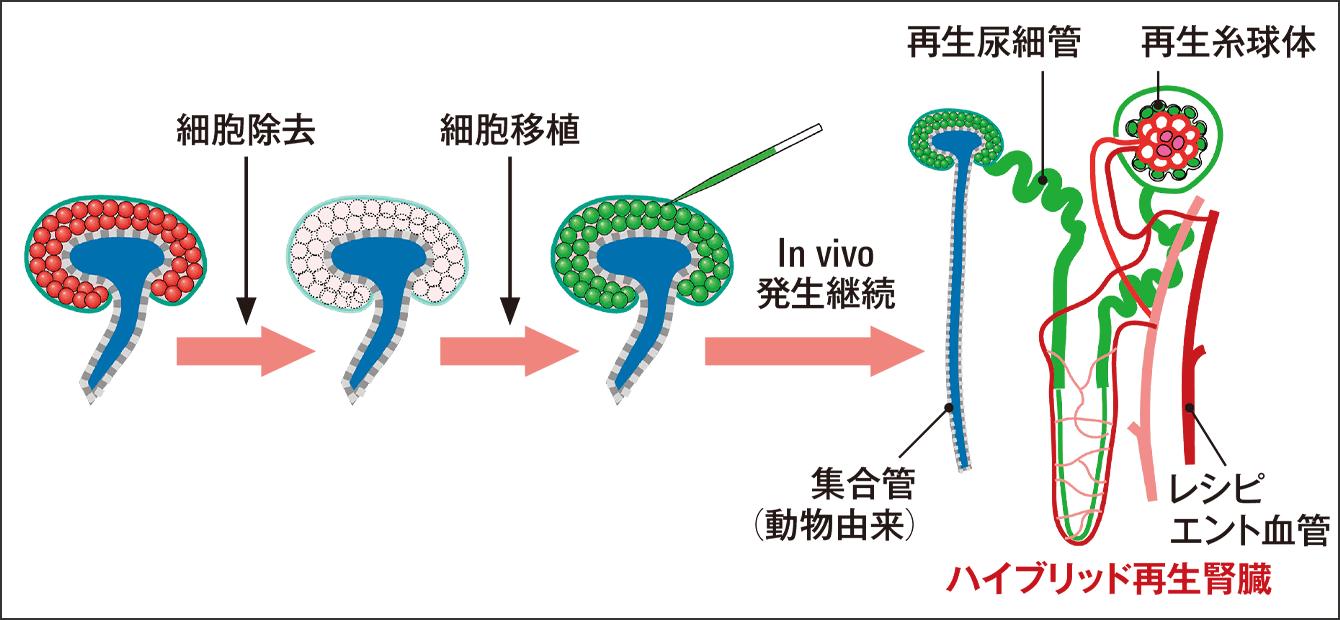
図4 胎生臓器補完法100%外来由来のネフロン前駆細胞からできた腎臓を樹立させるため、異種のネフロン前駆細胞を細胞死させる遺伝子操作を行った動物をつくり、異種胎仔のネフロン前駆細胞が安全に除去されるシステムも開発した。これにより、ヒトへの臨床応用がさらに近づいた。
キメラの異種のネフロン前駆細胞を細胞死させる薬剤は、高い安全性が求められる。研究当初はジフテリア毒素を使っていたが、ヒトの体に害を与えるので、現在は乳がんのホルモン療法の治療薬として使われている抗エストロゲン薬のタモキシフェンで駆動する除去システムを新たに開発した。ヒトへの使用が認可されている抗がん剤で、乳がん治療時は長期間の服用が必要だが、異種のネフロン前駆細胞の排除には1週間程度の服用でよいという。
横尾主任教授らの研究チームは、再生腎臓に対する尿排泄路の構築も成功させている。胎仔期の腎原器(後腎)と尿管と膀胱原基(総排泄腔)のひとかたまり(クロアカグラフト)を移植すると、レシピエント(臓器の受容者)から後腎に血管が侵入して発育が継続され、レシピエントの血液をろ過した尿が総排泄腔に貯留することになる。そこでこの拡張した総排泄腔とレシピエントの尿管を接続することにより、再生腎臓で生成された尿がレシピエントの膀胱まで誘導される。このシステム(SWPU:Stepwise Peristaltic Ureter system)により再生腎臓が水腎症を起こさず成熟することが可能となる。
「現在では、ヒトでの臨床応用に向けて、ブタと霊長類のカニクイザルで前臨床研究を続けています。成熟したブタ腎臓をサルに移植するには強力な免疫抑制が必要です。しかし野生型ブタの生後間もない新生仔期の腎臓と、胎仔のクロアカグラフトを同じサルに移植したところ、ブタ胎仔のクロアカグラフトの移植だと拒絶反応を低く抑えられることが分かりました。これまでの異種移植は、移植されるドナーブタの複数の遺伝子を改変することで行われ、免疫抑制が非常に難しいのですが、胎仔の腎臓を使うことで、非常にうまく抑えられることが分かり、有効性も検証できています」
ハイブリッド臓器の課題と可能性
ヒトで行う場合を想定すると、患者から20ccくらい採血してiPS細胞を作り、ネフロン前駆細胞を作る。遺伝子改変したブタの2㎜くらいの胎仔の後腎内のニッチに、ヒトiPS細胞由来ネフロン前駆細胞を注入する。そして、ブタのクロアカグラフトを内視鏡手術で移植し、麻酔が覚めたころに患者に異種のネフロン前駆細胞を除去させる薬剤を服用してもらう。ニッチの中では、異種の腎臓発生のプログラムが発動して、ヒトiPS細胞由来ネフロン前駆細胞が腎臓へと育っていくのだ(図5)。
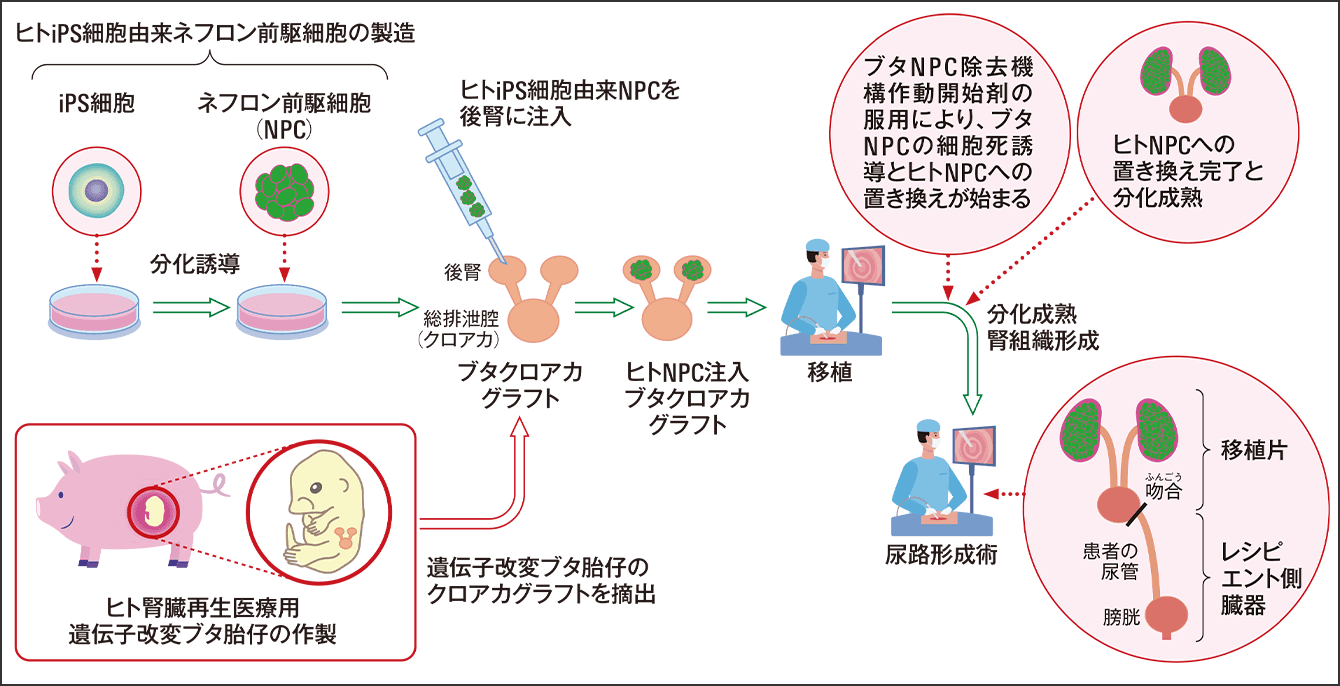
図5 ヒトへ応用する場合の手順ブタの胎仔の腎臓が発生するニッチを借りて、ヒトの腎臓を再生する研究は最終段階に入り、ブタと霊長類のカニクイザルでの研究が進む。ヒトでの応用には乗り越える課題は多いが、他分野と協働の腎臓再生コンソーシアムが組織され、実用化の日が近づいていることが期待されている。
「未知のブラックボックスといえる腎臓発生のプログラムが自動的に働き、ヒトのiPS細胞から再生された腎臓へと育ち、血管も入ってきて、尿が産生されます。実際には、人工透析をしている患者は尿が出ない場合が多いのですが、使われていない尿管につなげます。そうすると、産生された尿が患者の膀胱まで誘導され、普通に尿意を感じて、尿道から尿を排泄することができるようになるのです」
ただし、ヒトへの応用には、日本では異種移植に対する規制が厳しく、ドナーブタからヒトに感染する危険性のある病原体数十種類のスクリーニングが必要となる。また、異種再生医療は、iPS細胞の作製や管理などに始まり、さまざまな工程が必要だ。他大学や民間企業の研究グループなどと、密な連携が必要だし、開発費用や製品化した場合のコストなど、経済面で他分野との協働が求められる。これらいくつもの課題を乗り越えて、初めてヒトでハイブリッド臓器による異種再生医療を実施できる。現在では他大学の農学部、獣医学部、工学部など多くの分野や製薬会社の参画によって、国内に腎臓再生コンソーシアムが組織され、精力的に研究が進められている。
そして横尾主任教授は、「ヒトでの安全性確認を、5年以内に行いたい」と、力を込めた。人工透析、腎移植、そして異種再生医療による再生腎臓など、治療の選択肢が増えれば、患者が主体的に選べる日は、そう遠くはないはずだ。